
W.J.Pilsak
Os vírus são responsáveis por um amplo campo de doenças transmitidas através da água, como diarreias, meningite asséptica, encefalites, hepatites e anomalias cardíacas. Águas tratadas nem sempre têm segurança virológica, pois podem ser contaminadas ao longo da rede de distribuição; normalmente, a qualidade da água se garante mediante avaliações microbiológicas e de outros parâmetros físico-químicos, mas no Brasil, infelizmente não se avalia a presença de partículas virais infecciosas e muito menos é realizada a sua quantificação. As partículas virais podem escapar à filtração devido ao pequeno tamanho e também são mais resistentes do que as bactérias aos diversos processos de tratamento - inclusive às concentrações de cloro adotadas usualmente.
Os principais responsáveis por viroses associadas a águas são as enteroviroses, dentre elas o poliovírus, Rotavírus, Calicivírus, alguns Adenovírus e o vírus da hepatite A[1]. Segundo a OMS, mais de 2000 pessoas morreram no Brasil no ano 2012 por doenças associadas à inadequada higiene e saneamento básico[2].
Características gerais do vírus[]
Introdução[]
Os Rotavírus são a causa mais importante de gastroenterite severa no mundo; entre 50 e 60% dos casos de gastroenterites em crianças hospitalizadas são causados por este vírus[3]. Cálculos realizados em 2006 revelaram que uma criança vai à óbito por minuto no mundo por causa deste patógeno[4].
Os Adenovírus causam uma variedade de doenças como gastroenterites, pneumonia, doença respiratória aguda, meningites, hepatites e miocardite[5], e tal como os Rotavírus, são transmitidos pela via fecal-oral, sendo o contato ou a ingestão de água contaminada e o contato pessoa-a-pessoa os principais meios de infecção.
Classificação[]
O Rotavírus é um gênero da família Reoviridae. Atualmente, são descritos sete diferentes grupos de Rotavírus, de A à G, sendo os A, B e C que infectam o homem e estão associados às patologias. Dentre esses, os do grupo A são os de maior ocorrência. Os antígenos que determinam o sorotipo estão localizados em duas proteínas do capsídeo externo: a glicoproteína VP7 e a proteína VP4.
Os Adenovírus são membros da família Adenoviridae. Estes apresentam seis subgrupos, de A à F, de acordo com características antigênicas, morfológicas e moleculares, somando mais de 50 sorotipos em humanos, sendo os do tipo 2 e 5 do subgrupo C os mais bem estudados. Já se é falado de uma espécie com características distintas das demais, surgindo como o subgrupo G, mas ainda não foi concretizado[6].
Estrutura da partícula viral[]
O Rotavírus apresenta simetria icosaédrica de aproximadamente 100 nm de diâmetro (esférico).
O Adenovírus também tem simetria icosaédrica com diâmetro de 70-100nm.
Tipo de ácido nucleico[]
Os vírus entéricos são classificados em diferentes famílias e grupos, devido as suas diferenças estruturais.
No caso do Rotavírus, o genoma é constituído por uma fita dupla de RNA, mas este é dividido em 11 fragmentos, em que cada segmento pode ter de 660 à 3300 pares de bases. Tais RNAs codificam seis proteínas estruturais nomeadas VP1, VP2, VP3, VP4, VP6 e VP7; e seis proteínas não estruturais, as NSP1-NSP6.
Já o Adenovírus apresenta um DNA linear de dupla fita (aproximadamente 36kb) rodeado por proteínas, formando uma camada chamada de capsômero com 252 subunidades, em que 240 são héxons e 12 são pentons.
Composição[]
O capsídeo do Rotavírus é composto por três camadas de proteínas: a mais externa contém VP7 (glicoproteína) e VP4 (dímeros ou trímeros), sendo que essa última proteína é ancorada à VP6, que é uma proteína que forma uma camada intermediária; a camada interna é formada pela proteína VP2 (dímeros) que interage com moléculas VP1 e VP3. Logo abaixo temos uma camada de RNA também icosaédrica, com cerca de 25% do genoma (5000 pares de bases), e o restante do material genético está dentro da estrutura formada.

Esquema simplificado do Adenovírus. Feito por: Amanda S. Hirata
O Adenovírus tem um capsídeo icosaédrico não-envelopado composto principalmente por proteínas hexon, sendo que cada vértice deste tem uma base formada por um pentâmero anelar de proteínas, da qual sai a fibra responsável pela união do vírus às células hospedeiras, já que se une com grande afinidade à proteína de superfície celular Cocksakie-Adenovírus Receptor (CAR). Esta interação permite que as proteínas pentâmeras se unam aos receptores celulares αvβ3 e αvβ5, o que promove a endocitose da partícula viral mediada por integrinas. Dentro da célula o vírus escapa do endossoma penetrando sua membrana antes de ser degradado e se une aos poros do núcleo celular onde libera o material genético e a proteína VII para poder se replicar[7]. Para que haja montagem correta do capsídeo necessita-se de mais proteínas de revestimento, como: IIIa, VI e VIII, participando pelo lado interno, e a IX, pelo lado externo[8].
Hospedeiros[]
Os Rotavírus infectam diferentes mamíferos e pássaros[9]. Já os Adenovírus podem infectar seres vertebrados em geral[6], de modo que o gênero do vírus que determinará seu hospedeiro.
Replicação e Multiplicação[]
Rotavírus[]
Sendo um vírus entérico, o rotavírus infecta e replica-se em enterócitos, ou seja, células com microvilosidades do epitélio do intestino delgado. Ele é capaz de resistir ao ambiente ácido do estômago e às enzimas digestivas intestinais por conta de sua tripla camada proteica (TLP).
A principal proteína relacionada à entrada do vírus na célula é a VP4, uma proteína suscetível à proteólise pela tripsina. Ela liga-se a receptores que medeiam a endocitose, de modo que o rotavírus é envolvido por membrana e endocitado pela célula. Em sequência, as proteínas VP7 e VP4, que compõem a terceira camada, são capazes de romper a membrana do endossomo.
Há pouco conhecimento sobre como exatamente esse processo ocorre, mas há teorias de que o cálcio tenha um papel importantíssimo na estabilização das proteínas do capsídeo externo do rotavuris [10], ou seja, o rompimento da membrana do endossomo ocorre pela diferença de cálcio intra-endossomal, cuja concentração é igual ao meio extra-celular, e citosólica, fazendo com que as proteínas do capsídeo externo se desestruturem. VP4 dá origem à duas proteínas nesse processo, chamadas VP5* e VP8* que, juntamente com a VP7, atuam na membrana endossomal e a rompem, liberando o vírus no citosol.
Sabendo que a VP4 é uma proteína que sofre proteólise pela tripsina[11], enzima abundante no intestino em processos digestivos, há teorias que dizem que a ação dessa enzima sobre a VP4 faz com hajam mudanças conformacionais sítios adicionais na superfície glicoproteica, acarretando em possibilidade de ação com co-receptores das células humanas que geram resposta endocítica, de modo que o vírus acaba por ser endocitado pelo enterócito. Esse processo não é bem entendido, tampouco como a membrana endossomal é rompida, mas tem-se certeza que, a partir de um endossomo, o vírus é liberado no meio citossólico[12].
O rotavirus agora constitui-se de seu material genético (dsRNA) envolto de uma dupla camada proteica (DLP), que funciona como uma maquinaria de RNA polimerase RNA-dependente, passando a transcrever o genoma viral, que é extrudido para o citossol e, então, traduzido e replicado.
A replicação viral é restrita ao citoplasma celular e ocorre dentro de estruturas eletro-densas especializadas denominadas Viroplasmas, adjacentes ao núcleo e próximas do retículo endoplasmático, e que tem seu tamanho aumentado conforme os ciclos virais ocorrem[12]. Os viroplasmas são "fábricas virais", que crescem e acumulam proteínas rotavirais, em especial as não-estruturais (NSP2, NSP4, NSP5), que são as responsáveis pela patogenicidade do vírus e que tem alguma relação, ainda não muito esclarecida, com a replicação viral, visto que a falta delas gera falhas na morfologia viral ou silenciamento total de sua replicação. A progênie viral é liberada da célula quando ela sofre lise. [11][13]
Adenovírus[]
Pelo fato do seu material genético ser DNA dupla fita linear, é sabido que os adenovirus tem sua replicação ocorrendo no núcleo das células de vertebrados, usando a maquinaria de replicação da célula hospedeira. Não são todos os sorotipos de adenovírus que infectam exclusivamente células entéricas; apesar de estarem classificados como enterovírus, há sorotipos que infectam células pulmonares e também dá conjuntiva ocular[14]. A replicação do adenovírus em todos os tipos celulares se dá de maneira semelhante.

Entrada do Adenovirus na célula hospedeira e sua replicação.
De Pharmaceuticals 2010, 3(10), 3343-3354
Os adenovírus entram na célula do hospedeiro através do processo de endocitose, através de duas formas: ligando-se ao receptor CD46 (sorotipos do grupo B dos adenovírus[15][16]) ou ao Receptor Coxsackievirus-Adenovirus /CAR (todos os outros sorotipos de adenovirus[17][18][19]). Realizada esta primeira conexão com seu receptor, o penton do adenovírus interage com a αv integrina, que age como um co-receptor importante para estimular a sua entrada na célula [20][21]. Ou seja, a interação com essa integrina resulta na endocitose do adenovírus, mediada por clatrina, de modo que este fique num endossomo, no citossol. A interação do penton do adenovírus com a αv integrina acarreta em processos que levam a permeabilização da membrana endossomal, através da acidificação intravesicular por bombas de prótons, que tem sua formação induzida justamente por essa ligação[22][23][24][17]. Assim, o endossomo sofre lise e/ou o adenovírus é liberto no citossol, de modo que, através de interações com os microtúbulos celulares, é direcionado à membrana nuclear,liberando seu material genético dentro do núcleo, através do poro nuclear[25][17]. A partir de então, o vírus passa para o processo de replicação, enfim.
A replicação do adenovírus é separada em duas fases, chamadas inicial (early phase) e tardia (late phase), que transcrevem genes de mesma denominação. Os early genes expressam para proteínas não estruturais que têm função regulatória, como alterar a expressão de proteínas da célula hospedeiras importantes na síntese de DNA, ativar outros genes virais como a DNA polimerase viral, bloquear a apoptose, ação de interferon e TNF-α e transcrição de MHC de classe I. Enquanto os early genes são codificados, o Promotor Principal Tardio (Major Late Promoter - MLP) é ativado, entretanto com baixa atividade, sendo ele responsável pela expressão dos late genes, que codificam para as proteínas estruturais do vírus. Em dado ponto da replicação, quando a quantidade de proteínas iniciais é significativa, o MLP é altamente ativado, passando a expressar as proteínas tardias massivamente. A late phase consiste, basicamente, na montagem dos vírus, de modo que a célula hospedeira se lisa no momento em que há proteínas estruturais suficientes para conter todo material genético replicado. O processo de lise celular não é muito bem esclarecido, mas acredita-se que seja por motivos físicos, ou seja, a quantidade viral intracelular é tão grande que a célula não resiste e se rompe. [26][27][28]
Patogenia[]
Rotavírus[]
Sete grupos de Rotavírus infectam animais, mas o sorotipo A é o responsável pela maioria das doenças em humanos[3], apesar dos sorotipos B e C também serem patogênicos[5]. A desidratação ocasionada pela diarreia é mais comumente achada em pacientes com este vírus que com outros causadores deste sintoma[29].
Assim como por infecções por Norovírus, Astrovírus e Kobuvírus, os sintomas por Rotavírus se apresentam depois de passadas entre 24 e 48 horas da exposição[29]. Estes sintomas incluem diarreia (sem sangue), vômito, febre, debilidade/fraqueza, dor de cabeça e dor abdominal.
A virulência é multifatorial e não se compreende totalmente. As proteínas VP7 e VP4 são os principais objetivos de anticorpos neutralizantes. A proteína NSP1 funciona como um antagonista de interferon, diminuindo a resposta imune[30]. A NSP4, uma enterotoxina responsável por vários sintomas, incluindo a diarreia, também é alvo dos anticorpos produzidos. Tem-se demonstrado que a aquisição passiva de anticorpos contra NSP4 diminui tanto a incidência quanto a severidade da diarreia em ratos inoculados com o vírus[31].
Uma causa da diarreia é simplesmente a morte de células entéricas, muito maior que a natural na presença de vírus entéricos. No caso do Rotavírus, a proteína NSP4 causa diarreia por produzir secreção de íons de cloreto através de canais dependentes de cálcio, interrompendo a função do transportador SGLT1 envolvido na reabsorção de água, além de possivelmente induzir a secreção dependente de cálcio das células entéricas nervosas[32].
A infecção por Rotavírus é autolimitada: passada cerca de uma semana, o quadro se resolve. O risco de morte se dá pela desidratação grave por falta de tratamento adequado durante esse período[30]. A hidratação é fundamental durante a infecção e, na realidade, representa a diferença entre uma gastroenterite transitória e uma letal. Uma grande porcentagem das pessoas que são hospitalizadas por rotavirose chegam ao hospital sem terem tomado soro de hidratação oral, de modo que seja necessária uma intensificação nas campanhas para hidratação por soro nesses casos de gastroenterite[33], soro esse disponibilizado gratuitamente em postos públicos.
Adenovírus[]

Células epiteliais infectadas por adenovírus (cortesia do material didático do Instituto de Ciências Biomédicas da Universidade de São Paulo)
A infecção por adenovírus pode ou não causar doença. Este vírus é transmitido pelas rotas fecal-oral e conjuntiva, assim como por partículas suspensas no ar. Os adenovírus têm um período de incubação de dois a quatorze dias, em geral.
Os Adenovírus causam infecções liticas (ex. células mucoepiteliales), latentes (ex. células linfoides e adenoides) e transformantes (em hamsters). Infectam o epitélio orofaríngeo, órgãos respiratórios e entéricos. Após infecção aguda, o vírus pode persistir em tecidos linfoides como adenoides, amígdalas e placas de Peyer, pelo que pode ser ocasionalmente reativado em pacientes imunossuprimidos.
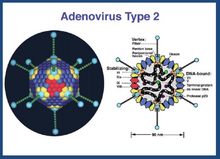
Estrutura do Adenovírus
As infecções liticas são resolvidas principalmente por anticorpos. A imunidade celular controla o crescimento da carga viral. Os adenovírus usam varias estrategias para escapar do sistema imune; codificam RNAs que impedem a inibição da síntese viral mediada por interferon e bloqueiam a apoptose induzida por respostas celulares com as proteínas E3 e E1A. Alguns sorotipos inibem a apresentação de antígenos no MHC I[9].
Os Adenovírus causam principalmente doenças respiratórias parecidas à gripe, e conjuntivite. Os sorotipos 40 a 42 causam gastroenterite aguda, sendo popularmente chamados Adenovírus entéricos (grupo F). Em pacientes imunossuprimidos pode causar infecções sistêmicas, pneumonia e hepatite[9].
Diagnóstico[]
Diagnóstico em pessoas infectadas[]
Clínico[]
Em geral, as doenças causadas por vírus entéricos têm os primeiros sintomas semelhantes e portanto, como o tratamento é parecido também, o diagnóstico é feito com base no histórico do paciente e também em outros relatos. Assim, se há um aumento no número de infectados por rotavírus em determinada região, é provável que um paciente que venha daquela região se queixando de diarreia é diagnosticado com infecção por rotavírus também.
O procedimento é este, mesmo existindo testes rápidos e práticos para um diagnóstico mais preciso. Hoje existem kits para identificar o vírus em amostras de fezes baseados em métodos imunoenzimáticos de detecção de antígenos[34] e até testes de aglutinação do látex, que utilizam partículas de látex revestidas com a imunoglobulina G (IgG) anti-rotavírus e são especificamente aglutinadas na presença do Rotavírus[35]. Estes testes apresentam alta especificidade e sensibilidade, além de seu resultado ser visível macroscopicamente.
Laboratorial[]
Um diagnóstico laboratorial é mais preciso e, apesar de demorar mais e ser mais complexo, trás resultados concretos e um diagnóstico definitivo. A técnica laboratorial mais utilizada para identificar vírus entéricos é chamada de ELISA, mas outra técnica também utilizada, mas com menor frequência por demorar mais para dar o resultado, é a técnica de PCR em tempo real (RT-PCR ou qPCR)[36].
ELISA[]

ELISA
A técnica de Elisa é um ensaio imunoenzimático muito sensível para quantificar proteínas. O ensaio consiste em capturar a proteína viral de interesse usando anticorpos específicos para o antígeno, sendo que um destes estará conjugado a uma enzima que irá converter o substrato incolor em um com cor que então será medido no espectrofotômetro. Para isso se utiliza uma placa sensibilizada com anticorpos monoclonais específicos para um antígeno. Desta forma, quando colocada a amostra na placa, esses anticorpos chamados de primários capturam o antígeno. Então após isso é adicionado o anticorpo secundário, o conjugado e em seguida o substrato.
PCR e qPCR[]
A técnica de PCR consiste em amplificar pequenos e poucos fragmentos de DNA a fim de se descobrir a existência do material genético desejado em determinada amostra. Por isso na clínica é possível utilizar essa técnica para dar o diagnóstico da infecção por um vírus como o Adenovírus ou o Rotavírus. A grande diferença entre o PCR convencional e o PCR em tempo real (qPCR) é que com a segunda metodologia podemos quantificar a quantidade de material genético que esta sendo gerado, enquanto no convencional apenas observamos a presença ou não. Sendo assim, as técnicas ocorrem da seguinte maneira:
A reação depende de um cDNA gerado a partir de mRNA extraído dos tecidos e para isso é necessário uma enzima de transcriptase reversa. Além disso, alguns elementos básicos são necessários, como primers, dNTPs, a enzima DNA polimerase e um tampão. Com esses materiais, e utilizando um termociclador, é possível sintetizar o cDNA que será utilizado no PCR, pois esse será amplificado em ciclos que aumentam e abaixam a temperatura para dar as condições ideais para a enzima agir e amplificar o material genético.
Já no PCR em tempo real, o cDNA obtido é pipetado em uma placa, o mix de primers, em seguida o cDNA, e após isso o SYBR ou o TaqMan, que são mix do conjugado responsável por fornecer a luminescência das amostras que serão lidas e quantificadas, acoplando-se entre as bases nucleotídicas de dupla fita. Assim, quando as amostras estão no aparelho de RT-PCR e passam pelos ciclos de duplicação de DNA, os fluoróforos vão sendo liberados e emitindo a luz que é lida pelo aparelho. Para duplicar o DNA, o aparelho repete ciclos em que ele eleva a temperatura até 90ºC para denaturar as fitas duplas, em seguida abaixando-a até 50ºC para o anelamento dos primers, elevando-a na sequência até aproximadamente 60ºC, que seria a temperatura ideal para o funcionamento da enzima - processo parecido com o de síntese de cDNA.
Diagnóstico virológico aplicado à água contaminada[]
A identificação de partículas virais na água é de suma importância para a saúde pública, uma vez que vírus entéricos possuem rota oral-fecal e, portanto, saem do organismo através das fezes. Sendo assim, eles podem chegar à água de rios, lagos e até na água que é utilizada em casas, em casos onde o saneamento básico não é tão eficiente.
O Adenovírus é muito utilizado para classificar a água como contaminada ou não, por ser extremamente prevalente e resistente, e assim conseguir resistir com sucesso e em grandes quantidades no ambiente aquático[37]. Por conta disso, muitos dos testes são baseados nesse vírus, porém a estrutura básica para se diagnosticar não muda e pode ser dividida em 4 etapas [38]. Primeiramente, deve-se coletar o material, ou seja, água com suspeita de contaminação ou esgoto e, em seguida, uma das etapas de maior importância e que pode variar de acordo o material a ser analisado e o que se pretende identificar, que é a etapa de concentração de partículas virais. Os vírus, para infectar humanos, não precisam de uma carga grande de partículas virais. Por isso, mesmo que na água a concentração dessas partículas não seja grande (para os entéricos cerca de 10 a 100 partículas são suficientes), ainda há o risco de infecção. Porém, para as análises de diagnóstico, é preciso ter uma concentração alta dessas partículas, então são necessários métodos que concentrem, isto é, aumentem a quantidade de partículas virais na amostra a ser analisada. Existem diversos métodos para tal, e como dito, a escolha do método vai depender do tipo de amostra, do vírus a ser isolado e mesmo de recursos financeiros do laboratório. De qualquer modo, os métodos mais utilizados são a adsorção-eluição em membranas polarizadas,ultracentrifugação e a ultrafiltração [37].
A ultracentrifugação consiste em precipitar os vírus na amostra centrifugando-as em altíssimas velocidades, de modo que os vírus podem ser facilmente separados após precipitarem. O grande problema desse método é que as centrífugas que atingem a velocidade necessária para precipitarem os vírus não possibilitam centrifugar grandes volumes de água de uma só vez. [38].
Já a ultrafiltração depende do uso de ultramembranas que retêm macromoléculas (ácidos nucléicos e proteínas). Essas membranas contêm poros capazes de reter massas moleculares na ordem de 10.000 a 100.000 Da, sendo geralmente utilizadas em associação com a microfiltração[38].
O método de adsorção-eluição (VIRADEL) em membranas polarizadas é um dos mais utilizados e também por apresentar alta eficiência. Nesse método é explorada uma característica dos vírus de possuírem em sua estrutura proteínas carregadas eletricamente, o que faz com que, ao se alterar o pH da água, seja possível carregar as partículas virais todas positivamente ou negativamente e, utilizando uma membrana também carregada, possam ser concentradas essas partículas[38]. Após concentrar os vírus, o terceiro passo é purificar o concentrado da presença de substância citotóxicas e inibidoras de reações enzimáticas como ácidos húmicos e fúlvicos, presentes naturalmente nas amostras ambientais devido a decomposição de matéria orgânica. Estas substâncias interferem tremendamente nos métodos de diagnósticos a serem utilizados posteriormente. A etapa seguinte consiste na aplicação de métodos de diagnóstico clássicos como cultivo em culturas de células ou métodos moleculares como PCR, RT-PCR ou sequenciamento gênico. A cultura celular é usada para que os vírus tenham condições de se replicar e multiplicar e neste caso verificamos se as partículas virais detectadas nas amostras tem capacidade de infecção e consequentement, de causar doença. As culturas também podem ser utilizadas para a quantificação das partículas. A partir delas também pode-se extrair o material genético dos vírus, porém essa etapa pode ser realizada diretamente do concentrado viral. O método de extração do material genético mais utilizado é a extração por fenol-clorofórmio, pois não interfere com a reação de PCR, que é a última etapa para o diagnóstico: a etapa de detecção viral. No caso de vírus cultiváveis in vitro é possível identificar o vírus a partir da cultura celular, porém para outros casos (vírus não cultiváveis) são necessários métodos moleculares como o PCR, RT-PCR ou o qPCR, que são os mais amplamente utilizados[37]. Mesmo identificando a presença do vírus na cultura celular pela visualização de efeito citopático, este resultado é apenas presuntivo, fazendo-se necessária a confirmação do resultado por técnicas moleculares ou utilizando anticorpos específicos marcados.
Epidemiologia[]

Porcentagem de testes positivos para rotavírus, por semana de vigilância. Estados Unidos, Julho 2000-Junho 2009
Os enterovírus são transmitidos principalmente pela via fecal-oral, tendo em vista que eles estão presentes no trato gastrointestinal do hospedeiro e são eliminados junto com suas fezes. Além disso, devido sua presença nas fezes, outros reservatórios virais, além do próprio organismo infectado, são fontes de infecção, como por exemplo esgoto, solo, comida contaminada e água potável proveniente do abastecimento público[37]. Com relação a este último, é importante que não haja rachaduras ou defeitos nos canos de coleta e distribuição de água, uma vez que, caso haja pequenas fissuras em ambos os canos, os vírus presentes no esgoto podem atravessar as tubulações junto com a água de esgoto e contaminar o solo, podendo alcançar a tubulação de água potável que será distribuída pelas casas, contribuindo para a disseminação dos vírus. Tendo em vista a forma de contágio do vírus, constata-se que uma melhoria no setor de saneamento básico diminuiria consideravelmente o número de casos de gastroenterites causadas por enterovírus, que possuem maior incidência em regiões com falhas no saneamento básico.
Os Rotavírus são a principal causa de gastroenterites em crianças no mundo e, com o 95% das crianças infectadas entre os 3 e os 5 anos[9]. Este vírus causa a morte de 1 milhão de pessoas por ano pela desidratação. O vírus persiste em ambientes secos, como brinquedos e mãos.
Os Adenovírus são liberados da faringe e nas fezes pelas pessoas infectadas durante períodos longos (meses), a maioria dos casos sendo assintomáticos, o que faz com que a pessoa não perceba que está doente e contribua para a disseminação do vírus. Os Adenovírus 1, 2, 5 e 6 são os responsáveis por 5% a 10% dos casos de doença respiratória em crianças, e por 15% dos casos de hospitalização por gastroenterite[9]. Os tipos 40 e 41 são causadores de gastroenterite.
Prevenção e controle[]
Higiene[]
Tendo em vista que as principais formas de disseminação dos enterovírus é através da rota fecal-oral e da água contaminada, recomenda-se a lavagem das mãos com água e sabão, tratamento da água potável proveniente do abastecimento público, além de adequadas condições de saneamento básico. A forma de transmissão do vírus faz da lavagem das mãos um dos métodos mais efetivos para impedir sua propagação e produção de epidemias.

Tratamento da água[]
No geral os vírus transmitidos pela rota fecal-oral são resistentes a condições ambientais diversas, como amplo espectro de pH, radiação, salinidade e temperatura. No tratamento da água para eliminar vírus há várias alternativas como filtração, cloração, tratamento térmico e tratamento com luz UV, a filtração sendo o menos efetivo, visto que os vírus, em geral, são extremamente pequenos, muitos deles atravessando os poros dos filtros.
Adenovírus são tão susceptíveis à cloração da água como a maioria dos vírus, mas são os mais resistente ao tratamento com UVC (low-pressure UV)[5]. Os virions dos Rotavírus resistem a pH entre 3,5 e 10, assim como o tratamento com detergentes[9].
Caso uma pessoa não conte com água adequadamente tratada, recomenda-se fervê-la.
Vacina[]
Para a prevenção do Rotavírus atualmente se conta com duas vacinas, ambas baseadas em vírus atenuados.
Existe uma vacina monovalente (GSK), contendo o sorotipo atenuado G1. Ela é administrada em duas doses, com um intervalo de dois meses entre ela, a primeira sendo recomendada entre a 6ª e 14ª semana de vida. Esta vacina tem uma eficácia entre o 65 e 93%.
Está disponibilizada também uma vacina pentavalente (MSD) contra o Rotavírus, que protege contra 5 sorotipos do vírus. Esta contem quatro vírus humanos (G1, G2, G3 e G4) e um vírus bovino (P1) e tem uma eficácia que varia entre o 65 e 93% dos casos. Esta vacina é indicada para crianças menores de 6 meses, que são o grupo mais susceptível da população. A vacina é administrada pela via oral e em três doses, aos dois, quatro e seis meses de idade.
No Brasil, a vacina do laboratório MSD só está disponível na rede privada, enquanto a GSK pode ser encontrada tanto na rede pública quanto na privada.
Segundo o CVE (Centro de Vigilância Epidemiológica), levando em conta a inclucação da vacina no Brasil em 2006, entre 2007 e 2009, foram evitadas 1.500 mortes e 130.000 hospitalizações relacionadas às diarreias[38]. É importante ter em mente que estas vacinas não oferecem proteção contra diarreias ou outras doenças causadas por outros vírus entéricos.
Atualmente não esta disponibilizada nenhuma vacina contra o Adenovírus, mas o exercito estado-unidense vacina seus soldados contra alguns sorotipos do vírus (4 e 7) com uma vacina aprovada pela FDA para uso em pessoal militar entre os 17 e 50 anos de idade[39].
Tratamento clinico das doenças associadas[]
Na infecção por Rotavírus ou qualquer vírus que cause doença gastrointestinal, o tratamento consiste no controle da desidratação com soro de hidratação oral ou se for preciso hidratação intravenoso.
Doenças causadas por vírus entéricos que afetam órgãos como figado, pulmão, coração e cérebro requerem um atendimento especial do caso clínico.
O antiviral Cidofovir é especialmente usado em infecções graves por Adenovírus em pessoas imunossuprimidas, mas tem efeito citotóxico em rins[39].
Crise hídrica e relação com enteroviroses[]
O tratamento do esgoto não é homogêneo no Brasil. De acordo com o último estudo conduzido pelo IBGE, publicado em 2011 (referente a dados coletados em 2008), apesar de quase 70% do esgoto coletado (havendo também lugares onde saneamento básico não existe e este não é nem coletado, ficando ao ar livre) ter sido tratado, essa quantia equivale a 30% dos municípios do país, principalmente os do Sudeste. Além disso, quase metade dos municípios brasileiros não tem rede de coleta de esgoto, a maioria estando no Norte e Nordeste do país. No tratamento da água potável, quanto à análise microbiológica o principal teste realizado é o bacteriológico. Dos municípios brasileiros, 61,2% realizam este tipo de análise, predominando a análise quinzenal ou mensal, sendo também muito comum análises semanais ou diárias. Entretanto, atualmente não há nenhum protocolo em vigor quanto à análise viral. Isso leva à ocorrência de enteroviroses na população. Atualmente, a frequência dessas viroses aumentou. Quando a situação hídrica estava normal, a água e o esgoto passavam, paralelamente, sob grande pressão pelos canos, levando a um vazamento natural de até 30% de seu volume para o solo em volta. Com a crise, a pressão passou a ser desligada em determinados momentos. Isso permitiu a infiltração desse volume vazado para dentro dos canos, levando à contaminação da água já tratada. Por isso houve um aumento dos casos
Referências[]
- ↑ Tavares, T. M.; Cardoso, D. D. P.; Brito, W. M. E. D. (2005). "Vírus Entéricos Veiculados Por Água: Aspectos Microbiológicos e de Controle de Qualidade da Água".
- ↑ "Burden of disease inadequate water, sanitation and hygiene in low- and middle-income countries". Global Health Observatory Data Repository. Organização Mundial da Saúde (OMS).
- ↑ 3,0 3,1 Anupam Mukherjee, Shiladitya Chatopadhyay, Mamta Chawla-Sarkar. "Rotavirus Infection in India: A Major Cause of Childhood Gastroenteritis". Proc. Natl. Acad. Sci. Sect B. Biol. Sci. (January–March 2012) 82(1):135–151.
- ↑ NewsRx (2006) Eastern Virginia Medical School; "Study finds Merck oral vaccine effective". Health Insurance Law Weekly, Atlanta, p 30
- ↑ 5,0 5,1 5,2 Kellogg Schwab. Waterborne Gastroenteritis Viruses. "Human Viruses in Water. Albert Bosch" (Editor). 2007 Elsevier B.V.
- ↑ 6,0 6,1 MARINHEIRO, J. C. (2009). “Variabilidade genética de adenovírus humano da espécie B, associados a casos de infecção respiratória aguda, em São Paulo, de 1995 a 2006”. Instituto de Ciências Biomédicas, Universidade de São Paulo; Brasil.
- ↑ Marc Tebruegge and Nigel Curtis. "Adenovirus Infection in the Immunocompromised Host."
- ↑ DUARTE, P. (2009). “Desenvolvimento da linhagem celular LEY79SF para produção de adenovírus livre de partículas competentes de replicação”. Instituto de Ciências Biomédicas, Universidade de São Paulo; Brasil.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 Murray. Microbiología Médica.
- ↑ M.C. Ruiz, J. Cohen, F. Michelangeli. "Role of Ca2+ in the replication and pathogenesis of rotavirus and other viral infections" Cell Calcium, 28 (2000), pp. 137–149
- ↑ 11,0 11,1 Jayaram H, Estes MK, Prasad BV (April 2004). "Emerging themes in rotavirus cell entry, genome organization, transcription and replication". Virus Research 101 (1): 67–81.
- ↑ 12,0 12,1 Greenberg HB, Estes MK (May 2009). "Rotaviruses: from pathogenesis to vaccination". Gastroenterology136 (6): 1939–51
- ↑ Ruiz MC, Leon T, Diaz Y, Michelangeli F (2009). "Molecular biology of rotavirus entry and replication".TheScientificWorldJournal 9: 1476–97.
- ↑ Sarantis, Helen, et al. "Comprehensive detection and serotyping of human adenoviruses by PCR and sequencing." Journal of Clinical Microbiology 42.9 (2004): 3963-3969.
- ↑ Gaggar, Anuj, Dmitry M. Shayakhmetov, and André Lieber. "CD46 is a cellular receptor for group B adenoviruses." Nature medicine 9.11 (2003): 1408-1412.
- ↑ Marttila, Marko, et al. "CD46 is a cellular receptor for all species B adenoviruses except types 3 and 7." Journal of virology 79.22 (2005): 14429-14436.
- ↑ 17,0 17,1 17,2 Meier, Oliver, and Urs F. Greber. "Adenovirus endocytosis." The journal of gene medicine 6.S1 (2004): S152-S163.
- ↑ Walters, Robert W., et al. "Adenovirus fiber disrupts CAR-mediated intercellular adhesion allowing virus escape." Cell 110.6 (2002): 789-799.
- ↑ Roelvink, Peter W., et al. "The coxsackievirus-adenovirus receptor protein can function as a cellular attachment protein for adenovirus serotypes from subgroups A, C, D, E, and F." Journal of virology 72.10 (1998): 7909-7915.
- ↑ Nemerow, Glen R., and Phoebe L. Stewart. "Role of αv integrins in adenovirus cell entry and gene delivery." Microbiology and Molecular biology reviews 63.3 (1999): 725-734.
- ↑ Li, Erguang, et al. "Integrin αvβ1 is an adenovirus coreceptor." Journal of virology 75.11 (2001): 5405-5409.
- ↑ Wang, Kena, et al. "Regulation of adenovirus membrane penetration by the cytoplasmic tail of integrin β5." Journal of virology 74.6 (2000): 2731-2739.
- ↑ Medina-Kauwe, Lali K. "Endocytosis of adenovirus and adenovirus capsid proteins." Advanced drug delivery reviews 55.11 (2003): 1485-1496.
- ↑ Waye, Mary Miu Yee, and Chor Wing Sing. "Anti-viral drugs for human adenoviruses." Pharmaceuticals 3.10 (2010): 3343-3354.
- ↑ Suomalainen, M., et al. "Adenovirus‐activated PKA and p38/MAPK pathways boost microtubule‐mediated nuclear targeting of virus." The EMBO journal20.6 (2001): 1310-1319.
- ↑ Farley, Daniel C., Jason L. Brown, and Keith N. Leppard. "Activation of the early-late switch in adenovirus type 5 major late transcription unit expression by L4 gene products." Journal of virology 78.4 (2004): 1782-1791.
- ↑ Berk, Arnold J. "Recent lessons in gene expression, cell cycle control, and cell biology from adenovirus." Oncogene 24.52 (2005): 7673-7685.
- ↑ Young, A. M., and Iain A. McNeish. "Oncolytic adenoviral gene therapy in ovarian cancer: why we are not wasting our time." (2009): 339-357.
- ↑ 29,0 29,1 E.Duizer and M. Koopmans. "Gastroenteritis viroses". National Institute for PublicHealth and the Environment (RIVM), The Netherlands.
- ↑ 30,0 30,1 Benati, F. J., Maranhão, A. G., Lima, R. S., da Silva, R. C., & Santos, N. (2010). "Multiple‐gene characterization of rotavirus strains: Evidence of genetic linkage among the VP7‐, VP4‐, VP6‐, and NSP4‐encoding genes". Journal of medical virology, 82(10), 1797-1802.
- ↑ Vizzi E et al (2005). "Evaluation of serum antibody responses against the rotavirus nonstructural protein NSP4 in children after rhesus rotavirus tetravalent vaccination or natural infection". Clin Diagn Lab Immunol 12:1157–1163.
- ↑ Hyser JM, Estes MK (January 2009). "Rotavirus vaccines and pathogenesis: 2008".Current Opinion in Gastroenterology 25 (1): 36–43.
- ↑ Cáceres, D. C., Peláez, D., Sierra, N., Estrada, E., & Sánchez, L. (2006). "La carga de la enfermedad por rotavirus en niños menores de cinco años", Colombia, 2004. Rev Panam Salud Publica, 20(1), 9-21.
- ↑ National Center for Immunization and Respiratory Diseases, Division of Viral Diseases. Disponível online em: http://www.cdc.gov/adenovirus/hcp/diagnosis.html. Atualizado 20/04/15
- ↑ Silveira, Waldemir de Castro. "Desenvolvimento de teste rápido para detecção de rotavírus: imunoensaio de captura e aglutinação em látex." (2005).
- ↑ Dr. Ananya Mandal, DM. Diagnóstico da Infecção do Vírus Adenóide. Disponível online em: http://www.news-medical.net/health/Adenovirus-Infection-Diagnosis-%28Portuguese%29.aspx. Atualizado 17/04/2013
- ↑ Feachem, R., H. Garelick, and J. Slade. "Enteroviruses in the environment." Tropical diseases bulletin 78.3 (1981): 185.
- ↑ Divisão de Imunização/CVE/CCD/SES-SP. "Vacina contra rotavírus". Centro de vigilância epidemiológica, São Paulo. Atualizado em 26 de fevereiro de 2013 e disponivel online em: http://www.cve.saude.sp.gov.br/htm/imuni/rota_idade.htm
- ↑ 39,0 39,1 Ananya Mandal. Tratamiento y Prevención de la Infección del Adenovirus. Ultima atualização Apr 17, 2013. Disponível online em: http://www.news-medical.net/health/Adenovirus-Infection-Treatment-and-Prevention-%28Spanish%29.aspx