Características gerais do vírus[]
Estrutura e composição da partícula viral[]

Organização da partícula viral do HIV. Courtesy: National Institute of Allergy and Infectious Diseases.
A partícula viral do HIV é composta por um capsídeo formado pela proteína p24, apresenta aproximadamente 120 nm de diâmetro e possui forma esférica. [1] O HIV-1 – forma mais virulenta da partícula – possui RNA fita simples de senso positivo com aproximadamente 9749 nucleotídeos que está relacionado com a codificação das enzimas Transcriptase Reversa e Integrase, e proteínas que formam o nucleocapsídio.[2]
O nucleocapsídio está associado ás partículas do virion denominadas Vif, Vpr, Nef e protease viral, que pode ser usada como alvo para danificar o vírus.[1] O vírus HIV tem simetria icosaédrica e membrana externa. Essa membrana torna o vírus mais vulnerável á sabão, podendo perder também seus receptores que o fazem reconhecer células hospedeiras.
O envelope viral é formado a partir da membrana da célula hospedeira que é levada após o brotamento do capsídeo. Ele é formado pelas glicoproteínas gp120, responsáveis pelo reconhecimento da molécula de CD4 do sistema imune e gp41.
Tipo de ácido nucléico[]
O genoma do vírus HIV é constituído por duas cópias de RNA simples fita de senso positivo e por três genes principais: gag, pol e env, os quais codificam enzimas virais e proteínas estruturais.[3]
Classificação[]
De acordo com o ICTV (International Committee on Taxonomic of Virus), o HIV (do inglês, Human Immunodeficiency Virus), é classificado como um Lentivírus (gênero) da família dos Retrovírus.[4]Os lentivírus têm como característica longos e variáveis períodos de incubação, grande interação com o hospedeiro,capacidade de destruir células do sistema imune e causar alterações neurológicas no organismo infectado.[5]
HIV-1 e HIV-2 são as duas únicas formas de lentivirus encontradas em humanos, sendo que a primeira é considerada mais virulenta. [5] Estes dois tipos de HIV se originaram de duas espécies de primatas distintas e compartilham de 40 a 50% de suas características genéticas. Ambos tem como receptor a molécula de CD4 encontradas principalmente em linfócitos T CD4+, porém o HIV-2 possui menor afinidade por esta molécula se comparado ao HIV-1. Além disso, a diversidade genética do HIV-2 é menor que a de HIV-1. Essa aparente tenuidade do HIV-2 sobre o HIV-1 induziu estudos para identificar se haveria uma possível relação de proteção da infecção por HIV-2 sobre uma posterior infecção por HIV-1. Os resultados apontaram que, quando infectado por HIV-2, um individuo apresentará 60% de proteção contra uma subsequente infecção por HIV-1.[6]
Origem e Hospedeiros[]
Por volta de 1930, com a caça rotineira nos períodos de guerra e fome na África,os vírus Pan troglodytes troglodytes e Pan troglodytes vellerosus, que habitavam chimpanzés no sul da República dos Camarões (país localizado no centro oeste africano) conseguiram adentrar no ser humano por escoriações e ferimentos de pele. Esses vírus ganharam a capacidade de alcançar as secreções genitais e passou a ser transmitido por relações sexuais. Mutações tornaram esse vírus diferentes daqueles que estavam nos chimpanzés e foi se alastrando durante guerras de independência e guerras civis, campanhas de vacinação pelo uso de agulhas não descartáveis e não esterilizadas, sendo que desse modo, nascia uma doença e se espalhava de forma explosiva por toda a África. A doença foi ocultada por várias mortes supostamente causadas por pneumonias, diarréias, tuberculose e desnutrição.
Na extremidade oeste do continente, os macacos mangabey da floresta da Guiné-Bissau transmitiram aos humanos um vírus similar ao dos chimpanzés de Camarões. As rebeliões de Cabo Verde e da Guiné-Bissau visando independência de Portugal, geraram miséria e migração de refugiados para áreas vizinhas, espalhando o vírus entre as diversas nações e permitindo a chegada na Europa, especialmente à Portugal, através de soldados feridos e infectados.
Os vírus foram se disseminando através de embarcações e aviações para novos continentes e foram descobertos apenas na década de 80, recebendo o nome de HIV. Após a descoberta, uma amostra de sangue coletada de um negro no Congo em 1959 foi descongelada no Estados Unidos e envidenciou a existência do vírus já naquela época. A AIDS, portanto, ganhou as manchetes dos meios de comunicação.
O vírus da AIDS foi classificado em dois tipos: aqueles originados dos chimpanzés de Camões foram denominados tipo 1 e aqueles originados dos macacos da Guiné-Bissau, tipo 2. Ainda hoje macacos e chimpanzés convivem com os vírus, porém esses foram denominados SIV (vírus da imunodeficiência do símio) e essa história só pode ser desvendada com o desenvolvimento da genética, na qual foram encontradas muitas semelhanças entre o material genético do HIV e SIV.[7]
Multiplicação[]

Ciclo de replicação do vírus HIV na célula hospedeira. Courtesy: National Institute of Allergy and Infectious Diseases.
As glicoproteínas gp120, presentes no envelope do vírus HIV, reconhecem as moléculas de CD4 na superfície de algumas células do sistema imune, destacando-se os linfócitos T CD4+. A gp120 está ligada à superfície do virus através da glicoproteína gp41 que é essencial, pois com a ligação à CD4, a conformação da gp120 se altera, deixando a gp41 exposta a co-receptores presentes na superfície de monócitos, macrófagos e linfócitos T. Os co-receptores mais conhecidos são o CCR5 e o CXCR4, pertencentes à família das quimiocinas. Quando os co-receptores se ligam à gp41, esta, por sua vez, também sofre uma mudança conformacional, permitindo que haja a fusão das membranas viral e celular e, posteriormente, a liberação do conteúdo viral na célula hospedeira.[8]
São lançadas no interior da célula, além das duas fitas simples de RNA, enzimas como transcriptase reversa, integrase e protease. A partir de cada uma das fitas é gerada uma molécula de DNA dupla fita pela ação da enzima transcriptase reversa e o DNA viral é transportado para o núcleo da célula onde consegue ser integrado ao genoma do hospedeiro a partir da atividade da integrase, passando a ser chamado de provírus. [9]
O DNA viral integrado pode vir a controlar uma infecção ativa - pelo início da transcrição de genes virais e, logo, síntese de novos vírus, que sairão da célula - ou permanecer em estado latente, onde o provírus não faz sua replicação em si, é somente replicado junto com o DNA da célula, na formação de células filhas.[10] No primeiro caso, a RNA polimerase transcreve o DNA viral em RNA mensageiro (mRNA), e tanto esta etapa como o processamento do mRNA envolvem a participação de enzimas da própria célula. Ocorre a transcrição de genes que resultarão em proteínas envolvidas na regulação do ciclo, enzimas, proteínas estruturais e também do próprio RNA genômico.[8]
A expressão de proteínas virais pode ser dividida em duas fases: a formação de proteínas precoces, que são as primeiras a serem sintetizadas e são não estruturais, atuando, em geral, na própria transcrição e replicação do genoma viral ou sobre o metabolismo celular, modificando-o para favorecer a síntese de componentes virais e a formação de proteínas tardias, que são estruturais e irão compor a partícula viral. [11] Algumas dessas proteínas virais precoces são a Tat e a Rev. A primeira está envolvida, entre outros processos, no controle da transcrição dos genes virais, por meio da sua associação a diversos fatores de transcrição da célula hospedeira, podendo aumentar a eficiência da transcrição pela estimulação da RNA polimerase, por exemplo. Já a segunda permite que os mRNAs de proteínas tardias sejam transportados do núcleo para o citoplasma para serem traduzidas.[12]
Após seu processamento no núcleo, o mRNA é transportado para o citoplasma, onde ocorre sua tradução por ribossomos presentes na superfície do retículo endoplasmático rugoso. Quando proteínas do envelope viral são codificadas, elas entram no retículo endoplasmático rugoso e são direcionadas, posteriormente, para a superfície celular. Ao mesmo tempo, outras proteínas essenciais para a formação do vírus (como as componentes do capsídeo proteico e enzimas) estão sendo codificadas e sendo enviadas para a região da membrana onde as proteínas do envelope estão localizadas, sendo que algumas dessas proteínas se complexam com o RNA viral; este material, agrupado, é expelido para o meio extracelular envolto pelo envelope que contém proteínas de membrana virais e, também, da célula. Porém este vírus ainda não é maduro: algumas cadeias polipeptídicas ainda precisam ser clivadas pela enzima protease para se tornarem proteínas maduras. Com isso, forma-se, então, o HIV maduro, que poderá infectar outras células. [8] [13]
Latência e reservatórios de HIV[]
O vírus HIV se replica em linfócitos T CD4+ ativos, porque estes expressam fatores necessários para transcrição reversa, integração e expressão do DNA viral. Como exemplo de um fator que interfere na expressão do DNA viral está o fator de transcrição pró-inflamatório NF-κB, cuja expressão é induzida após ativação de linfócitos T CD4+; tal fator tem um papel importante no início da transcrição da sequência de DNA viral e expressão das proteínas virais primárias.[14]
Os dois primeiros processos não ocorrem nos linfócitos T CD4+ em repouso (que não foram ativados pela apresentação de um antígeno específico) infectados, caracterizando a latência pré-integração. Esse DNA viral extracromossomal (que não está integrado) permanece viável por semanas após a infecção, constituindo um reservatório por certo intervalo de tempo, uma vez que, se tais células forem ativadas subsequentemente à infecção, o DNA viral se integrará e poderá gerar novos vírus.[15]
Quando ocorre a ativação dos linfócitos T CD4+, que podem já estar infectados com o vírus ou serem infectados posteriormente à sua ativação, há estimulo para a proliferação celular e, assim, é possível que ocorra a integração do DNA viral e replicação do HIV; porém este estado é transitório e, após um tempo, os linfócitos voltam à fase de repouso como células de memória. Com isso, proteínas virais deixam de ser expressas e o vírus entra no estado de latência pós-integração: deixa de se replicar, mas seu DNA continua integrado, formando o reservatório de HIV. Caso essas células voltem a ser ativadas, ocorrerá a reativação da replicação do HIV e da sua infecção.[15]
Nos macrófagos, que também são células que não estão em divisão e são o segundo alvo principal do vírus, não ocorre o bloqueio da síntese e integração do provírus, sendo assim, estes não abrigam o HIV em latência pré-integração, mas podem abrigá-lo em latência pós-integração, na qual mesmo com o provírus não há formação de novas partículas virais.[15]
Com isso, indivíduos HIV positivos têm grande risco de agravarem seu quadro ao contrairem novas infecções, sejam estas comuns ou mais sérias, já que as células em repouso contendo o vírus em latência podem ser ativadas, estimulando a replicação viral.
Patogenia[]
A AIDS é uma doença causada pelo contato com o vírus HIV sendo essa transmissão realizada de uma pessoa para outra. Logo após entrar em contato com o indivíduo, o vírus ataca suas células, principalmente os linfonodos, pois eles possuem uma grande quantidade de linfócitos T CD4+, os quais servem de receptores para o HIV.[16] Também podem ter como alvo monócitos/macrófagos, astrócitos e células do sistema nervoso central. A infecção se propaga através do tecido linfático, o qual contém células dendríticas que funcionam como reservatório para a fase latente do vírus.[3] Com a fusão do vírus na membrana do linfócito, há a injeção do seu RNA que, pela ação da transcriptase reversa, se transforma em DNA e fica no citoplasma. Quando o sistema imune percebe um ataque, o linfócito recebe um estímulo e é ativado, porém, o vírus se replica de maneira mais rápida e numerosa, o que causa a morte dos linfócitos e a consequente liberação dos vírus na corrente, que irão infectar outras células. [16]
No início da infecção, a doença apresenta sintomas inespecíficos podendo ser facilmente confundida com gripe e apresentar sintomas como exantema, adenopatia cervical, diarreia e vômitos.[17] Nessa fase, dita aguda, o indivíduo se torna altamente infectante, devido a alta proliferação do vírus, e a sorologia para a infecção por HIV é geralmente negativa.[18]
No período de 6 a 12 semanas ocorre uma soroconversão, que é o momento em que uma pessoa soropositiva tem anticorpos suficientes e específicos permitindo a detecção do vírus.
A soroconversão é seguida por uma fase assintomática que pode durar de meses a anos.Trata-se da latência viral. O vírus aparenta ter saído da circulação, porém, a replicação continua ocorrendo nos tecidos linfoides. Os vírus amadurecem e morrem de forma equilibrada, dessa forma, não enfraquece o organismo.
No estágio seguinte da infecção, os níveis de linfócitos TCD4+ sofrem uma drástica queda causando a destruição dos linfonodos e sintomas como febre, diarreia, suores noturnos e emagrecimento. Após uma maior replicação do vírus, atinge-se o estágio mais avançado, o indivíduo pode desenvolver doenças aparentes, principalmente infecções oportunistas, e sintomas constitucionais, como imunodeficiência. O principal mecanismo responsável pela imunodeficiência severa é a destruição dos tecidos linfóides o que acarreta a incapacidade do organismo de inibir a replicação viral. As células CD4+ ativadas, por expressarem elevada quantidade de receptores para quimiocinas, são facilmente infectadas pois tais receptores atuam como co-receptores para o vírus.[19] Assim, as células CD4+ são progressivamente infectadas e destruídas, há a uma grande supressão do sistema imune e o aparecimento de neoplasias, podendo ainda ocorrer infecções mais severas causadas por protozoários, bactérias e outros vírus.[11] Além disso, o HIV pode causar danos neurológicos, pois ataca predominantemente células da microglia e macrófagos. Estes, ao serem infectados, liberam substâncias tóxicas, levando a respostas inflamatórias e mortes de neurônios.[17]
Carga Viral[]

Carga viral do HIV e contagem de linfócitos T CD4+ através dos anos, sem tratamento. Imagem retirada de Wikimedia Commons.
A carga viral é a quantidade de vírus presente em certa quantidade de sangue. A carga inicial do HIV pode chegar a 1 milhão de cópias do vírus por ml de sangue nas primeiras semanas de infecção, mas logo se reduz para cerca de 1.000/ml. A partir desse momento, o número de cópias do vírus começa a subir mais lentamente. Normalmente, os sintomas começam a aparecer quando a carga viral é maior que 100 mil/ml[20]. O risco do organismo depende da taxa de CD4+, que é considerado vulnerável quando está abaixo de 200 células/mm3 de sangue[21].
Diagnóstico laboratorial[]
O Diagnóstico Laboratorial do HIV é realizado com o intuito de identificar indivíduos infectados, identificar portadores (doadores de sangue, órgãos, gestantes) e confirmar o diagnóstico de Aids. Saber do contágio precocemente aumenta a expectativa de vida do soropositivo e, se o tratamento for seguido de maneira correta, mães soropositivas têm 99% de chances de não passarem o vírus para seus filhos.

Esquema da reação entre anticorpo e antígeno no teste rápido. Imagem concedida pelo Dr.Ricardo Vasconcelos
O Diagnóstico é feito a partir da amostra sanguínea. É recomendado fazer o teste após 30 dias da possível infecção, pois se o teste for feito durante a janela imunológica (intervalo entre infecção e produção de anticorpos anti-HIV no sangue), há a possibilidade de o resultado ser um falso negativo. No Brasil, os testes são gratuitos e tem dois tipos: testes de laboratório e teste rápido. [19]
Teste Rápido[]
Permite a detecção em até 30 min na amostra de sangue do paciente, podendo ser realizado em uma consulta. O Departamento de DST, Aids e Hepatites Virais do Ministério da Saúde disponibiliza, também, um kit para um teste que detecta anticorpos anti-HIV, presentes no fluido oral, em aproximadamente 25 minutos. [22]
Teste Laboratorial[]
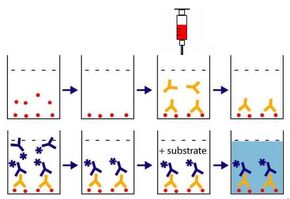
Esquema do procedimento ELISA. Imagem concedida pelo Dr. Ricardo Vasconcelos.
É realizado um teste de ELISA para avaliação do nível de anticorpos do indivíduo. Tal teste envolve anticorpos conjugados com enzimas e o resultado é dado por observação (qualitativa) ou pela medida espectofotométrica (quantitativa) da mudança de cor obtida após a reação. Para a detecção dos anticorpos, um antígeno viral é ligado ao suporte e a amostra teste (soro do paciente) é aplicada sobre ele. Após isso, um anticorpo antiimunoglobulina humana conjugado com enzima é adicionado e em seguida, o substrato, se a amostra for positiva, a enzima presente reage com o substrato e a cor muda. Se a enzima não estiver presente, a cor permanece inalterada e a amostra é considerada negativa. Caso o teste der positivo, são realizados testes adicionais como Western Blot e Imunofluorescência indireta para o HIV com a mesma amostra.[22]
O Western Blot é altamente sensível e específico, porém é caro. O procedimento envolve a separação das proteínas virais usando o método de SDS-PAGE (eletroforese em gel de poliacrilamida contendo SDS, um detergente). As bandas resultantes são transferidas para tiras de uma membrana de nitrocelulose. Cada tira serve como um Antígeno, o soro é aplicado e, em uma amostra positiva, forma-se um complexo antígeno-anticorpo que é visualizado após uma reação imunoenzimática utilizando um anticorpo antiimunoglobulina humana conjugado com uma enzima. [19]
Na Imunofluorescência indireta para o HIV-1, o soro do paciente é adicionado a uma lâmina contendo células infectadas com HIV fixadas. Anticorpos contra o Anti-HIV conjugado com fluoróforo são adicionados e o resultado é observado em microscópio de imunofluorência. Se houver fluorescência a amostra é positiva, na ausência de fluorescência, o paciente está livre de infecção.[19]
Se o resultado desses testes for positivo, o paciente é chamado para que os testes sejam refeitos com uma nova amostra.
Epidemiologia[]
A epidemiologia é o estudo que avalia a frequência da distribuição e causas do espalhamento de uma determinada doença visando, através desse esclarecimento, reduzir as taxas da mesma na sociedade. Para tanto é importante conhecer seu surgimento na população humana de forma a melhor compreender as causas e motivos do espalhamento da AIDS em nossa espécie.
Segundo respeitado artigo científico[23], com as primeiras pistas obtidas em 1986[24], o surgimento do vírus do HIV em humanos teria fortes relações com primatas selvagens, chimpanzés, do sudeste de Camarões - a transmissão dos primatas para humanos mostrou envolver principalmente o tipo 1 do vírus em questão (HIV-1), sendo este o principal causador da atual epidemia de AIDS.
O surgimento desse vírus foi testado a partir da avaliação de fezes de diferentes primatas de modo a obter informações inclusive da origem dos vírus nessas espécies para que então, fossem relacionadas ao humano. A avaliação das fezes foi feita sob análise de anticorpos e RNA’s ali presentes, gerando um consequente mapeamento genético do HIV - o teste dos anticorpos é feito para anticorpos do SIV (vírus semelhante ao HIV), encontrado em símios (espécie de primata). A partir disso, o estudo concluiu que múltiplos cruzamentos entre espécies de SIV teriam originado os dois tipos de HIV hoje conhecidos, HIV-1 e HIV-2. A análise dos diferentes vírus do HIV continuaram sendo analisadas em outras espécies quando então, em 1989, foram encontrados chimpanzés[25] e "sooty mangabeys"[26] que apresentavam, respectivamente, HIV-1 e HIV-2; ou seja, já que os mesmos tipos presentes em humanos foram identificados em outros primatas, a AIDS teria emergido em ambos graças a infecções entre espécies com lentivírus de outros primatas.
O primeiro contágio dos seres humanos pelo vírus, agora visto proveniente de certas espécies de primatas, não possui data oficializada. Acredita-se que muitas tribos já haviam sido infectadas por tal devido à prática antes frequente de caça a macacos o que, consequentemente, envolvia o contato do sangue do animal (já infectado) com o dos caçadores, que possuindo relações sexuais com prostitutas transmitiram o vírus para um maior número de pessoas. Entretanto, como a África é composta por várias tribos, este tipo de contágio apresentava sempre um potencial de transmissão baixo, possuindo um alcance local apenas. Mas com a formação de uma grande colônia, conhecida como Leopoldville (na atual República Democrática do Congo), o primeiro grande caso de transmissão do HIV foi registrado.[27]
AIDS no mundo[]

Prevalência de HIV em adultos (%) em 2006, pelo mundo. Em 2006, o número de pessoas infectadas pelo vírus HIV totalizava 39,5 milhões de pessoas (na margem de erro, esse número pode ser de 34,1 a 47,1 milhões). Imagem retirada do site da UNAIDS.[]

Número de pessoas vivendo com HIV em 2008; novas infecções com HIV em 2008 e mortes provocadas por AIDS em 2008, respectivamente. Imagem retirada do site da UNAIDS.[]

Novas infecções por HIV em 2011, totalizando 2,5 milhões de novos casos no mundo. Imagem retirada do site da UNAIDS.[]
A AIDS possui suas principais causas de transmissão diferentes de acordo com o público em questão, bem como possíveis formas de prevenção que relacionam-se aos recentes aumentos ou diminuições nos números de novos casos. Os principais grupos podem ser divididos em:
Homens com relações sexuais com homens; Profissionais do sexo; Mulheres; Transgêneros; Crianças. Em cada um desses grupos também estão presentes o grupo de risco "pessoas que injetam drogas".

Mapa mundi representando por anamorfose com os principais grupos soropositivos em cada continente onde os dados relativos à HIV são coletados. Imagem retirada do site da UNAIDS.[28][]
Homens com relações sexuais com homens (MSM):[29]
É importante ressaltar que são considerados integrantes desse grupo pessoas cujas relações sexuais tenham ocorrido ou ocorram, com homens, sendo eles não somente gays, mas também bissexuais, transgêneros e os "goys" (homens que se afirmam heterossexuais, mas que possuem relações sexuais com outros homens), sejam as relações frequentes, isoladas ou casos esporádicos. Historicamente, a AIDS foi primeiramente descoberta entre jovens gays do sexo masculino nos EUA e ao longo dos anos foram encontrados maiores níveis de infecção por HIV envolvendo esse mesmo público. Desde os primeiros anos de epidemia de HIV, que tornou-se conhecida através das relações homoafetivas entre homens, países como o Brasil exerceram forte pressão sobre o governo em prol de seus direitos, como aumentar a informação disponibilizada ao público geral - o Brasil foi pioneiro em campanhas públicas vinculadas pelos meios de comunicação alertando sobre a necessidade da utilização de camisinha principalmente em relações homoafetivas entre homens. Em muitos países entretanto, MSM têm menor visibilidade para debates, seja por preconceito ou até mesmo por ser uma prática criminalizada, em países como Irã, Mauritânia, Arábia Saudita, Sudão, Iêmen e partes da Nigéria e da Somália; prejudicando inclusive a coleta de dados para realização de estatísticas a respeito da expansão do HIV nessa população. Frente a essa dificuldade em debater e esclarecer sobre a transmissão do HIV, principal entre homens, torna quase impossível o andamento de campanhas e debates que alertem para a importância da prevenção de HIV - muitos infectados que também apresentam relações sexuais com homens têm esposas e, assim, transam sem camisinha podendo contaminá-las, se estiverem infectados).[30] A transmissão do vírus do HIV recebe maior destaque no público gay masculino por fatores relacionados à relação sexual em si e a situação onde frequentemente ocorrem. É mais fácil que o HIV seja transmitido através de sexo anal desprotegido do que por sexo vaginal, isso porque: o vírus do HIV é transmitido pelo sangue e, como no sexo anal - o ânus é um orifício mais estreito e irrigado que a vagina - é muito mais fácil que ocorram microfissuras e consequente sangramento do que no sexo vaginal, as chances de transmissão aumentam. Outro fator é que muitas vezes esse público faz sexo sem proteção quando pelo menos um dos indivíduos foi infectado há pouco tempo e, é justamente nessa fase que a carga viral é muito alta facilitando a transmissão do HIV. Em Londres, Reino Unido, um estudo sugeriu que 27% das infecções entre MSM eram de um parceiro recentemente infectado com HIV.[31] Não obstante, os espaços onde a sexualidade desses grupos não é banalizada ou humilhada, frequentemente são baladas, locais onde o álcool e drogas são uma parte comum do ato de socializar favorecendo um sexo sem segurança e com maior número de parceiros sexuais. Nos EUA, um estudo em Los Angeles concluiu que MSM usando metanfetamina (droga) foram 3 vezes mais susceptíveis a serem infectados com HIV do que os que não usavam.[32]
Profissionais do sexo:[33] Esse grupo é classificado como grupo de risco, principalmente graças à 3 fatores: múltiplos parceiros sexuais e uso inconsistente de camisinha, fatores sociais e legais e uso de drogas injetáveis. O uso de camisinha por esses profissionais pode ser dificultado por falta de informação relativa à sua informação, falta de acesso em países com menos políticas de profilaxia ao HIV e outras DSTs e por ofertas monetariamente mais atrativas para sexos onde o preservativo não esteja presente - a falta de acesso ocorre devido a sua marginalização e preconceito na sociedade, além da falta de proteções legais. O trabalho de proteção a partir de informação desses profissionais por ONGs especializadas é dificultado em 2/3 dos países, sendo considerado crime e, assim, combatido pela polícia local.[34] O "mercado do sexo" envolve também o uso de drogas, seja pelos clientes quanto pelos profissionais - dessa forma, o uso de drogas injetáveis mostrou-se um fator predominante de transmissão de HIV nesse grupo, maior que o próprio sexo inclusive. O potencial de transmissão desse grupo expande-se não só a seus clientes (maioria masculina), mas estes atuam como "ponte", transmitindo o HIV para a população em geral. [35]
Transgêneros:[36] Os casos mais comuns de HIV nesse grupo são nos transgêneros mulheres (pessoas nascidas homens, mas com identidade de mulher), sendo considerados um grupo de risco por fatores semelhantes aos dos homens que fazem sexo com homens (MSM). As relações sexuais desse grupo frequentemente apresentam sexo anal, ausência do uso de preservativo, 50% deles estão envolvidos com o prostituição.[37] Mesmo após a cirurgia onde é criada a estrutura sexual feminina (neo-vagina), os acompanhamentos médicos e o conhecimento sobre a saúde transitória do grupo são falhos, dificultando o conhecimento e acompanhamento sexual. Assim, marginalizados e vítimas de preconceito, o acesso a informações e ao uso de métodos preventivos, os transgêneros são considerados assim um grupo de risco.
Crianças:[38][]
Entre os anos de 2002 e 2013 os casos de infecção por HIV entre crianças (definidas pela UNAIDS como aquelas abaixo de 15 anos) foram reduzidos em 58% no número de novos casos[39]; entretanto, ainda assim, em 2013 foram registradas mais de 240.000 crianças infectadas pelo vírus. Ao todo, no final de 2013 havia 3.2 milhões de crianças vivendo com HIV ao redor do mundo, estando 91% delas na África sub-saariana - assim, por tratar-se de uma região com sistema de saúde precário e com altos números de infecção principalmente em adultos, somente 24% dessas crianças receberam o tratamento antiretroviral pediátrico (ARV).
A principal causa de transmissão do HIV entre as crianças é a transmissão vertical (de mãe para filho), podendo ocorrer durante a gravidez, parto ou amamentação; mas pode ser evitada através do tratamento com antiretrovirais (ARVs) administrados para a mãe e que, consequentemente, terão ação sobre o filho durante a gravidez (através da placenta) e durante amamentação (através do leite). Porém, novamente graças a sistemas precários de saúde pública, principalmente na África, maior foco da epidemia de HIV no mundo, e falta de informação e campanhas esclarecedoras, 54% das mulheres grávidas não realizaram nenhum teste para verificar a presença ou não do vírus, mas das que o fizeram e testaram positivo (têm HIV), 7 de 10 receberam o tratamento antiretroviral, evitando assim 900.000 novos casos (entre 2009 e 2013).[39] Em 2015, Cuba tornou-se o primeiro país a erradicar a transmissão vertical de HIV, segundo dados da OMS.[40]
Entretanto, 51% das mulheres não continua o tratamento durante a amamentação em comparação com 62% das que se tratam durante a gravidez e o parto; ou seja, há uma redução de 4% no total de mães que se cuidam até a fase de amamentação e, assim, esses 4% ainda pode infectar seus filhos com HIV[41] - a amamentação é responsável por metade do total de transmissões de mãe para filho, por isso é fundamental que sejam realizadas campanhas de conscientização a respeito da transmissão. Dessas crianças infectadas, se não tratadas continuamente, 1/3 morrerão antes de completarem 1 ano e metade não completará 2 anos.
Menores taxas de transmissão para crianças dão-se por transmissão sexual, principalmente em meninas, envolvendo casamentos precoces, permitidos e culturalmente aceitos em 52 países[39]; tornando-se frequente relações sexuais desde idades mais novas, maiores são as chances de infecção por HIV por envolverem parceiros mais velhos, sexo forçado e menor uso de preservativos. A injeção de drogas utilizando agulhas infectadas são as causas menos frequentes de contágio de crianças por HIV, envolvendo principalmente aquelas que vivem em orfanatos e nas ruas e que, portanto, não têm acesso à informação que alerta sobre os riscos de suas práticas.
Aids no Brasil[]
Desde o início da epidemia no Brasil, em 1980. O Brasil tem 656.701 casos registrados de aids (condição em que a doença já se manifestou), de acordo com o último Boletim Epidemiológico.Em 1980 primeiro caso da doença no Brasil, ocorreu em São Paulo,mas só dois anos mais tarde foi classificado como Aids, onde a transmissão ocorreu por transfusão sanguínea. Primeiramente, no Brasil o no mundo a AIDS foi denominada como a doença dos 5 H - Homossexuais, Hemofílicos, Haitianos, Heroinômanos (usuários de heroína injetável), Hookers (profissionais do sexo em inglês). Em 1983,o Brasil identifica primeiro caso de Aids entre mulheres. Neste mesmo ano ocorre também os primeiros relatos de transmissão heterossexual do vírus e de contaminação de profissionais de saúde. O Jornal do Brasil publica a primeira notícia sobre Aids no país:'' Brasil registra dois casos de câncer gay.'' No ano de 1985, o agente etiológico causador da Aids é denominado Human Immunodeficiency Virus (HIV). E também surge o primeiro teste diagnóstico para a doença, baseado na detecção de anticorpos contra o vírus. Entretanto, somente depois de 6 anos, em 1986 de AIDS no Brasil houve a criação do Programa Nacional de DST e Aids do Ministério da Saúde. No ano seguinte, em 1987 os pesquisadores do Instituto Oswaldo Cruz isolam o HIV-1 pela primeira vez na América Latina. E Iniciasse a administração do AZT, medicamento utilizado em pacientes com câncer, para o tratamento da Aids, mas somente 6 anos depois o AZT seria produzido no país. Alem desses grandes avanços, neste mesmo ano a Assembléia Mundial de Saúde e ONU estabelecem 1° de dezembro como Dia Mundial de Luta Contra a Aids.Em 1988, ocorreu o primeiro caso diagnosticado na população indígena brasileira. E até essa data o país já acumulava 4.535 casos da doença. Dois anos após, em 1990 mais de 6 mil casos de Aids são registrados no país. No ano seguinte, em 1991 o Ministério da Saúde dá início à distribuição gratuita de antirretrovirais, no Brasil. E o número de casos notificados passam de 11.800, neste mesmo ano a fita vermelha torna-se o símbolo mundial de luta contra a Aids. Em 1996, houve o primeiro consenso em terapia antirretroviral regulamenta, onde a prescrição do medicamento consistia em um tríplice esquema de antirretrovirais, que combina dois inibidores de transcriptase reversa e um de protease, começa a ser utilizado.E a Lei 9.313 estabelece a distribuição gratuita de medicamentos aos portadores de HIV, neste mesmo ano o Brasil já registrava mais de 22 mil casos de Aids, e já era uma doença muito bem homogeneizada no Brasil, após da feminização, interiorização e pauperização da epidemia. No ano de 1999 O Governo Federal divulga finalmente uma redução da doença, cerca de 50% de mortes e de 80% de infecções oportunistas, em função do uso do coquetel anti-aids. A partir dos anos 2000, as campanhas contra a Aids continuaram por todo o país, cinco grandes companhias farmacêuticas concordam em reduzir o preço de medicamentos antirretrovirais utilizados por países em desenvolvimento, como no Brasil. Houve também a criação do Fundo Global para o Combate a Aids, Tuberculose e Malária, para captação e distribuição de recursos em países em desenvolvimento. O Programa Brasileiro de DST/Aids recebe prêmio de US$ 1 milhão da Fundação Bill & Melinda Gates em reconhecimento às ações de prevenção e assistência no país, que abrigava até esse momento mais de 150 mil pacientes em tratamento.[42]
A doença aumentou progressivamente no Brasil até 2002, depois chegou a apresentar uma redução gradual até 2007, mas nos últimos anos voltou a crescer. O Brasil chegou a triste marca de mais de 600 mil casos da doença. Atualmente, ainda há mais casos da doença entre os homens do que entre as mulheres, mas essa diferença vem diminuindo ao longo dos anos. A maior taxa de incidência encontra-se entre pessoas com idades de 35 a 39 anos; 58 para homens e 36 para mulheres (a cada 100 mil habitantes). Mas ao longo do tempo, as taxas de incidência entre pessoas mais velhas aumentaram consideravelmente, chegando a dobrar entre pessoas acima dos 60 anos nos 10 últimos anos. Analisando a diferença entre os gêneros, a única faixa etária em que o número de casos de Aids é maior entre as mulheres é a de jovens entre 13 a 19 anos, que apresentam incidência de 3,1 a cada 100 mil habitantes (enquanto entre homens a incidência é de 2,4).[43]
Prevenção e controle[]
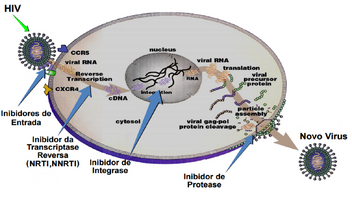
Principais alvos das drogas anti retrovirais, perante o ciclo de replicação do vírus. Imagem concedida pelo Dr.Ricardo Vasconcelos
Atualmente, os tratamentos destinados aos portadores de AIDS são baseados na utilização de drogas anti retrovirais combinadas, também conhecidos como TARV (Tratamento Anti RetroVirais). Eles têm como objetivo diminuir o nível de carga viral circulante e manter o funcionamento do sistema imune do paciente, prevenindo-o de outras infecções oportunistas.[44]
Um dos mais conhecidos é o HAART (Highly Active Anti Retroviral Therapy) que, geralmente, contém 3 drogas diferentes capazes de interferir na replicação viral, que poderão ser combinados em um só comprimido. Entre as drogas utilizadas estão inibidores da transcriptase reversa análogo de nucleosídeos (NRTIs), inibidores de proteases, inibidores de integrase, inibidores de entrada e inibidores da transcriptase reversa não-análogo de nucleosídeos (NNRTIs), entre outros.[45]
É importante ressaltar que o tratamento é complexo e necessita de acompanhamento médico. Pode haver efeitos colaterais, mas tais podem ser contornados de acordo com as doses, classes dos medicamentos prescritos e aderência ao tratamento.
Inibidores de entrada[]
O vírus HIV infecta, principalmente, as células CD4, a partir dos receptores gp120 e gp41, que estão localizadas em sua superfície, com auxílio de co-receptores conhecidos como CCR5 e CXCR4, completando assim a fusão.
Os medicamentos que conseguem atacar o vírus nesse estágio são conhecidos como inibidores de entrada/fusão. O fármaco enfuvirtida, também conhecido como T-20, é um exemplo desse tipo de inibidor .[46] Trata-se de um polipeptídeo constituído de 36 aminoácidos que é capaz de se ligar à uma região da gp41 impedindo com que sua conformação se altere de “pré-grampo” para a estrutura de fusão ativa, prevenindo, portanto, a fusão e a inserção do vírus na célula.[47]
Em fases de testes clínicos, outros fármacos estão se mostrando eficazes, agindo nessa etapa de fusão entre o vírus HIV e a célula hospedeira, porém atuando em outras partes do mecanismo de entrada, entre eles: PRO 542 e BMS 806, que bloqueariam a interação da gp120 com o receptor CD4; e AMD 3465, TAK 779 e SCH-351125 , que mostraram potencial para bloquear a interação da gp120 com os co-receptores CCR5 e CXCR4; [48]
Inibidor de Transcriptase[]
Uma vez que o material genético do HIV é implantado na célula hospedeira, a transcriptase reversa recodifica o RNA, convertendo-o em DNA, para que este possa se integrar no do indivíduo infectado.
- Inibidores Nucleosídeos da Transcriptase Reversa
Os Inibidores Nucleosídeos da Transcriptase Reversa (NRTI) possuem estruturas muito semelhantes às dos nucleosídeos que compõem o DNA, e por essa razão, conseguem se incorporar no meio da cadeia de DNA que está sendo sintetizada através da ação da transcriptase reversa – enzima na qual atua. Depois que o NRTI se junta ao novo DNA formado, a produção de uma nova cadeia é interrompida. [49] São eles: Abacavir, Lamivudina, Tenofovir, Zidovudina, entre outros.[50]
- Inibidores Não-Nucleosídeos da Transcriptase Reversa
Os NNRTI - Inibidores Não-Nucleosídeos da Transcritase Reversa - são inibidores do tipo não-competitivo, que interagem no sítio alostérico da transcriptase reversa. Desse modo, o sítio ativo, cujo papel levaria a formação da dupla hélice do DNA, tem sua mobilidade e flexibilidade alterada, resultando em uma diminuição da eficiência da enzima.
Somente três drogas foram aprovadas: Nevirapina , Etravirina e Efavirena[50]. Porém, mais de 30 classes de moléculas foram identificadas como potenciais inibidores da transcriptase reversa do HIV. Infelizmente, a maioria apresenta problemas na toxicidade, nas propriedades farmacocinéticas, na potencialidade contra vírus mutantes, entre outros fatores, o que acarreta no abandono em suas fases clínicas.[46]
Inibidor de integrase[]
O inibidor de integrase, como previsto pelo nome, interfere na atuação da enzima integrase que tem papel fundamental na integração do DNA viral no DNA celular. Assim, a replicação viral é interrompida.[51] Um exemplo desse tipo de inibidor é o Raltegravir, que foi o primeiro inibidor de integrase a ser aprovado para o vírus HIV tipo 1. Ensaios clínicos mostraram ainda que o seu uso como parte do tratamento é eficiente, pois tem uma atividade de antiretroviral potente e é bem aceito por indivíduos infectados.[52]
Inibidor de proteases[]
Para o vírion se tornar maduro e poder continuar seu ciclo de replicação em outras células, é fundamental que suas proteínas estruturais e funcionais estejam divididas e em sua conformação adequada.[53] Para que isso ocorra, é necessário a ação da protease viral, que processará as poliproteínas, levando à formação correta das mesmas, que, então, serão capazes de formar uma novsa partícula viral.
Desta forma, os inibidores da protease do HIV são capazes de interferir nesse último estágio da replicação viral. Eles previnem a formação de novos vírions, impedindo a associação do peptídeo a ser clivado com o sítio catalítico da protease. Entre eles estão o saquinavir, ritonavir, indinavir, amprenavir, lopinavir e atazanavir.[46]
Cura[]
A terapia antirretroviral (TARV) não pode ser interrompida, porque mesmo impedindo a replicação do vírus HIV ela não o elimina completamente, curando a infecção. Isso se deve ao fato de que o DNA viral está integrado, na forma de provírus latente, ao DNA da célula hospedeira, constituindo os reservatórios de HIV[54]. Ou seja, caso os medicamentos deixem de ser tomados e haja qualquer infecção, as enzimas importantes para a replicação viral (como a transcriptase reversa, integrase e protease) que antes estavam "inibidas" passam a funcionar normalmente permitindo que, nas células contendo o provírus em latência ativadas, estruturas virais sejam produzidas a partir do DNA viral e se formem novos vírus, que irão afetar novas células, o que aumentará o número de reservatórios e a carga viral do paciente, agravando seu quadro e fazendo com que as chances de infectar outro indivíduo sejam maiores.
Para uma cura do HIV seria necessário, além de impedir a replicação do vírus, eliminar seus reservatórios, já que sem eles não haveria risco de recidiva (retorno da doença). Porém a grande dificuldade em eliminar essas células é que elas não expressam antígenos virais permitindo que sejam reconhecidas pelo sistema imune do indivíduo, logo, não é possível diferenciá-las de células sem o provírus.[54]
Atualmente, há diversas pesquisas voltadas para que a supressão do vírus se mantenha por mais tempo após o indivíduo deixar de tomar a TARV, prevenindo a recidiva, ou seja, um aumento da viremia (vírus presentes no sangue) e piora no quadro do paciente por conta da descontinuidade do tratamento. [55]
Já que a presença dos reservatórios é a principal barreira para o desenvolvimento de uma cura, as principais estratégias voltadas para isso têm como alvo essas células que abrigam o HIV latente. Grande parte das pesquisas parte do principio de que a solução poderia ser a indução da expressão viral nas células T CD4+ em repouso, uma vez que estas morreriam pelo efeito citopático do virus ou por resposta do próprio sistema imune do individuo, além de que os virus que fossem liberados não infectariam outras células porque a TARV ainda estaria sendo tomada e, assim, seria possivel proteger as demais células da integraçao do genoma viral. [55]
Paciente de Berlim[]
O caso de Timothy Ray Brown, conhecido como paciente de Berlim, é o único que se tem até hoje de uma "cura" para o HIV, já que o vírus foi completamente eliminado de seu corpo, mesmo com a descontinuidade da terapia antirretroviral. Após ser diagnosticado com HIV, os médicos detectaram uma leucemia mieloide aguda (um tipo de câncer que afeta o sistema imunológico) e o paciente recebeu transplante de medula óssea.[56]
Acredita-se que a completa eliminação do vírus de seu organismo foi possível por dois motivos. Primeiro, o paciente foi submetido a diversas sessões de quimioterapia para a realização do transplante, o que eliminou grande parte das células que continham reservatórios. Segundo, o indivíduo doador continha uma mutação no gene responsável por codificar o co-receptor CCR5 - importante no processo de entrada do vírus nas suas células-alvo -, que suprimia sua expressão; assim, a nova população de células do sistema imune não possuía tal proteína em sua superfície, sendo resistente à infecção pelo vírus e impedindo a formação de novos reservatórios [55]. Tal procedimento foi repetido na tentativa de conseguir eliminar o vírus em outros pacientes, porém ainda não se obteve sucesso, já que volta a haver aumento da carga viral sem a terapia antirretroviral.
Porém tal procedimento só é adequado para pacientes que precisam de transplante de medula óssea por outra razão que não a infecção por HIV, além de que apresenta muitos riscos e desafios, pois deve-se encontrar um indivíduo com haplótipo de HLA compatível para o transplante e que também seja homozigoto para a mutação no gene do co-receptor CCR5 e o acompanhamento clínico deve ser bem rigoroso [55]. Em casos em que o doador não carregava o gene codificante do CCR5, após o transplante, observou-se uma queda na carga viral por alguns anos, porém houve recidiva da doença meses após a descontinuidade da terapia antirretroviral, mostrando que a mutação em tal gene foi importante para a cura do paciente de Berlim [57].
Bibliografia[]
- ↑ 1,0 1,1 http://en.wikipedia.org/wiki/Structure_and_genome_of_HIV
- ↑ http://www.learner.org/courses/biology/textbook/hiv/hiv_4.html
- ↑ 3,0 3,1 [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC553987/ Nielsen, M. H., Pedersen, F. S. & Kjems, J. Molecular strategies to inhibit HIV-1 replication. Retrovirology 2, 10 (2005).]
- ↑ http://emedicine.medscape.com/article/211316-overview
- ↑ 5,0 5,1 Fauci, A. & Desrosiers, R. Pathogenesis of HIV and SIV. 1997
- ↑ (Kanki, 1999)Kanki, P. J. (1999). Human immunodeficiency virus type 2 (HIV-2). AIDS Review, 1:, 101–108.
- ↑ http://pt.wikipedia.org/wiki/S%C3%ADndrome_da_imunodefici%C3%AAncia_adquirida
- ↑ 8,0 8,1 8,2 http://www.niaid.nih.gov/topics/HIVAIDS/Understanding/howHIVCausesAIDS/Pages/howhiv.aspx
- ↑ http://www.adarc.org/hiv_replication_632.html
- ↑ TORTORA, Gerald J. Microbiology: an introduction - 11th edition - Editora: Pearson - Cap. 19 : Disorder Associated with the Imune System; pages 546-547
- ↑ 11,0 11,1 TRABULSI, L.R.. Microbiologia. 4ª edição. Atheneu, 2004.
- ↑ [http://www.ncbi.nlm.nih.gov/pmc/articles/PMC553987/ Nielsen, M. H., Pedersen, F. S. & Kjems, J. Molecular strategies to inhibit HIV-1 replication. Retrovirology 2, 10 (2005).]
- ↑ http://www.avert.org/hiv-structure-and-life-cycle.htm
- ↑ Nabel, G. & Baltimore, D. An inducible transcription factor activates expression of human immunodeficiency virus in T cells. Nature 326, 711-713 (1987).
- ↑ 15,0 15,1 15,2 Garcia-Blanco, M.A. & Cullen, B.R. Molecular basis of latency in pathogenic human viruses. Science 254, 815-820 (1991).
- ↑ 16,0 16,1 http://medicinafontes.blogspot.com.br/2014/05/patogenia-do-hiv.html?m=1
- ↑ 17,0 17,1 MURRAY, P.R.. Microbiologia Médica. 6ª edição. Elsevier, 2005.
- ↑ http://www.aids.gov.br/pcdt/1
- ↑ 19,0 19,1 19,2 19,3 WIGG, M.D.; ROMANOS, M.T.V.; SANTOS, N.S. Introdução à Virologia Humana. 2ª edição. Guanabara Koogan, 2008.
- ↑ https://pt.wikipedia.org/wiki/Carga_viral
- ↑ U.S. Department of Health and Human Services. 2009. HIV and Its Treatment: What You Should Know.
- ↑ 22,0 22,1 http://www.aids.gov.br/
- ↑ Sharp, PM; Hahn, BH. Origin of HIV and AIDS pandemic. Cold Spring Harb Perspect Med. 2011, Sep. 1
- ↑ Clavel F, Guetard D, Brun-Vezinet F, Chamaret S, Rey MA, Santos-Ferreira MO, Laurent AG, Dauguet C, Katlama C, Rouzioux C, et al. 1986. Isolation of a new human retrovirus from West African patients with AIDS. Science 233: 343–346
- ↑ Huet T, Cheynier R, Meyerhans A, Roelants G, Wain-Hobson S 1990. Genetic organization of a chimpanzee lentivirus related to HIV-1. Nature 345: 356–359
- ↑ Hirsch VM, Olmsted RA, Murphey-Corb M, Purcell RH, Johnson PR. Nature. 1989 Jun 1; 339(6223):389-92.
- ↑ http://scienceblogs.com.br/rainha/2008/12/hiv-origens-i/
- ↑ http://www.unaids.org.br/
- ↑ http://www.avert.org/men-who-have-sex-men-msm-hiv-aids.htm#footnote4_m0x5mj5
- ↑ UNAIDS (2009), ‘UNAIDS Action Framework: Universal Access for Men who have Sex with Men and Transgender People
- ↑ Sullivan P. S. et al (2012, July) ‘ Successes and challenges of HIV prevention in men who have sex with men’ The Lancet, ‘HIV in men who have sex with men
- ↑ Peck J.A. et al. (2005), 'Sustained reductions in drug use and depression symptoms from treatment for drug abuse in methamphetamine-dependent gay and bisexual men', Journal of Urban Health, 82 (Suppl. 1)
- ↑ http://www.avert.org/sex-workers-and-hivaids.htm#footnote13_dawbmod
- ↑ UNAIDS (2010) ' UNAIDS report on the global AIDS epidemic'
- ↑ University of California (2009, 13 July) ' Tijuana sex workers' male clients raise HIV risk'
- ↑ http://www.avert.org/transgender-hiv.htm#footnote38_6mqhi7o
- ↑ Groves A. (2012, February) ‘ Transgender women and HIV’ HIV Australia 9
- ↑ http://www.avert.org/children-and-hiv-aids.htm#footnote14_ga3tq98
- ↑ 39,0 39,1 39,2 UNAIDS (2014, July) ' The Gap Report'
- ↑ http://brasil.elpais.com/brasil/2015/06/30/ciencia/1435677308_417885.html
- ↑ UNAIDS (2013) ' Global Report: UNAIDS Report on the Global AIDS Epidemic 2013'
- ↑ ww.ioc.fiocruz.br/aids20anos/linhadotempo.html
- ↑ http://www.orbis.org.br/analise/9/aids-apesar-do-controle-brasil-registra-quase-600-mil-casos
- ↑ http://en.wikipedia.org/wiki/Management_of_HIV/AIDS
- ↑ http://aids.about.com/od/hivaidsletterh/g/haartdef.htm
- ↑ 46,0 46,1 46,2 http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0100-40422008000800035
- ↑ http://serv-bib.fcfar.unesp.br/seer/index.php/Cien_Farm/article/viewFile/1283/1098
- ↑ http://www.latamjpharm.org/trabajos/24/2/LAJOP_24_2_6_2_H4JJ04IZ7O.pdf
- ↑ http://sida.roche.pt/tratamento/tratamento3.cfm
- ↑ 50,0 50,1 http://www.aids.gov.br/pagina/quais-sao-os-antirretrovirais
- ↑ http://cid.oxfordjournals.org/content/48/7/931.full
- ↑ http://www.ncbi.nlm.nih.gov/pubmed/19231980
- ↑ http://sida.roche.pt/tratamento/tratamento4.cfm
- ↑ 54,0 54,1 Genevieve Martin, Matthew Pace, John Frater. Hidden Menace: Curing HIV means finding and eradicating viruses still lurking in the shadows. The Scientist Magazine. May, 2015. Available at <http://www.the-scientist.com/?articles.view/articleNo/42831/title/Hidden-Menace/>
- ↑ 55,0 55,1 55,2 55,3 Chun, Tae-Wook, Susan Moir, and Anthony S. Fauci. "HIV reservoirs as obstacles and opportunities for an HIV cure." Nature immunology 16.6 (2015): 584-589.
- ↑ Cientistas tentam replicar tratamento que teria curado HIV em paciente de Berlim. Disponível em <http://agenciaaids.com.br/home/noticias/noticia_detalhe/22723#.VZNyuxtViko>
- ↑ T.J. Henrich et al., “Long-term reduction in peripheral blood HIV type 1 reservoirs following reduced-intensity conditioning allogeneic stem cell transplantation,” J Infect Dis, 207:1694-702, 2013.