Histórico[]
O primeiro contato descrito de seres humanos com vírus da família Filoviridae ocorreu em 1967, com o vírus Marburg, em surtos na Alemanha e na antiga Iugoslávia, quando indivíduos em laboratórios manipularam macacos verdes africanos (Cercopithecus aethiops) provenientes de Uganda . Muitos países colocaram em prática medidas de prevenção; os macacos foram eutanasiados e o surto foi contido pouco tempo depois [1][2].
Cientificamente a emergência do vírus ebola está datada em 1976, mas é possível que tenham ocorridos casos esporádicos antes desta data, no qual a falta de diagnóstico apropriado ou até mesmo de vigilância epidemiológica contribuíram para que não fossem relatados (Chippaux, J.P [3]). O primeiro caso ocorreu em Sudão, na cidade de Nzara (Sul do país), quando um trabalhador de uma fábrica de algodão relatou fortes dores de cabeça, febre e dores no peito, no dia 27 de Junho de 1976. No dia 30 do mesmo mês o cidadão deu entrada no hospital e após dois dias desenvolveu manifestações hemorrágicas, com forte sangramento nasal e diarreia sanguinolenta. No dia 6 de Julho do mesmo ano o paciente foi a óbito. Dessa mesma forma outros trabalhadores adoeceram, assim como parentes, amigos e agentes de saúde que prestaram atendimento aos enfermos, espalhando o surto para cidades vizinhas. Alguns meses depois foram notificado casos de pacientes apresentando sintomas semelhantes no Zaire (atual República Democrática do Congo). Amostras de pacientes foram enviadas a laboratórios do Reino Unido, Estados Unidos e Bélgica, onde perceberam algumas semelhanças com o vírus Marburg apesar das diferenças antigênicas. Assim, identificaram duas classes: Zaire ebolavirus e Sudan ebolavirus [4][5][6][3].
No ano de 1989, a contaminação por ebola foi detectada em macacos importados para Reston, Viriginia (EUA). Os macacos foram postos em processo de quarentena, não houve contaminação em humanos por ebola (Reston ebolavirus ). No entanto, entre 1994 e 1996 houve a contaminação de humanos em alguns sítios isolados (Costa do Marfim – 1994, República Democrática do Congo – 1995, Gabão – 1994, 1995, 1996) pelo já descrito Zaire ebolavirus e uma nova espécie: Taï forest ebolavirus (o nome foi dado devido ao Parque Nacional de Taï, na Costa do Marfim, local onde o vírus foi “encontrado”), que entrou em contato com humanos quando um etólogo se infectou ao realizar uma autópsia em um chimpanzé morto. Não houveram mais relatos de infecção até o ano de 2000, no qual 425 pessoas foram contaminadas com Sudan ebolavirus, resultando num total de 224 mortos. A partir daí, houve novas contaminações em Gabão, Republica Democrática do Congo e Sudão, não necessariamente relacionadas, totalizando 261 mortos até o ano de 2004, tanto por Sudan 'ebolavirus' quanto por Zaire ebolavirus [2][7] [8].
As contaminações voltaram a acontecer entre 2007 a 2009 nas mesmas regiões descritas anteriormente. Desta vez uma nova cepa foi isolada em Uganda, no distrito de Bundibugyo, onde 37 pessoas morreram de 149 contaminadas (Bundibugyo ebolavirus). Entre Maio de 2011 e Novembro de 2013 houve novas contaminações, principalmente por manuseio em laboratórios. 21 casos de morte foram confirmados [8].
Em 2014 ocorreu a maior epidemia de ebola já datada: mais de 20 mil pessoas foram infectadas, totalizando mais de 11 mil mortos. Estudos indicam que esta epidemia teve início em dezembro de 2013, aparentemente pela contaminação de uma criança com animais selvagens [9]. O surto, que teve início em Guiné, foi levado a vários países, gerando, em números absolutos, 11184 mortos (até junho de 2015) . O sequenciamento do genoma e análise filogenética demonstraram que esta cepa contaminante do vírus ebola difere das já descritas, podendo (ou não), ser uma forma evolutiva das anteriores [8][10][9].
[11]Características gerais do vírus[]
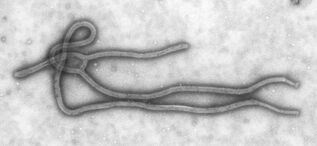
Microscopia eletrônica de transmissão da partícula viral Ebola. Imagem extraída de "Centers for Disease Control and Prevention's Public Health Image Library (PHIL)"
O vírus foi nomeado de Ebola por ser primeiramente reconhecido perto do vale do Rio Ebola durante um surto em Zaire (atual República Democrática do Congo) em 1976. Nos 27 anos subsequentes houve diversos surtos na África, com mortalidades variando entre 50%-90% [12]. Esse vírus é reconhecido por causar no hospedeiro a doença por vírus ebola (também conhecida como febre hemorrágica) e por ser um patógeno zoonótico, ou seja, um vírus que infecta animais e que pode ser transmitido a humanos.
O virus Ebola compreende membros do gênero Ebolavirus, pertencentes a família Filoviridae, da ordem Mononegavirales. Há 5 espécies do gênero ebolavirus, são elas:

Microscopia eltrônica de varredura do virion Ebola. Imagem extraída de WikiCommons
- Zaire ebolavirus;
- Sudan ebolavirus;
- Tai forest ebolavirus;
- Reston ebolavirus;
- Bundibugyo ebolavirus.
Todas, exceto Reston ebolavirus, podem causar doenças em humanos [13].
Estrutura da partícula viral[]
Vírus da família Filoviridae são filamentosos e possuem envelope lipídico coberto por projeções glicoprotéicas (de aproximadamente 10nm), importantes para a adsorção a receptores celulares e imunossupressão do hospedeiro. Fisicamente, possuem diâmetro de 80nm e comprimento variando de 300nm a 1,200nm, no qual a forma infecciosa possui 970nm, e apresenta um aspecto pleiomórfico (por microscopia eletrônica), podendo ser encontrado nas formas de "U", "b", "6", ou até mesmo circular, característica esta não encontrada em formas não-infecciosas. O nucleocapsídeo possui um espaço central de 20nm de diâmetro, e apresenta um capsídeo helicoidal de 50nm[14][15][16].

Representação esquemática da estrutura da partícula viral. Imagem gentilmente cedida pelo Dr. Ian M. Mackay. Disponível no blog:http://virologydownunder.blogspot.com.br/
Composição[]
Tipo de ácido nucléico[]
Apresenta RNA fita simples não segmentado de sentido negativo, a espécie Zaire ebolavirus possui cerca de 19kb e codifica 7 genes e 3 superposições. Algumas regiões são importantes para controlar a transcrição, a replicação e envelopamento de novos virions.[17] A transcrição e a replicação dos genes ocorre noo citoplasma da célula infectada. Os produtos destes genes são:

- Proteínas L (RNA polimerase)
- Proteína GP (glicoproteína do envelope)
- Proteína NP (nucleoproteína)
- Proteína VP30 (proteína ligadora de RNA)
- Proteína VP35 (capsídeo)
- Proteína VP40 (matriz)
- Proteína VP24 (intramembranar)
As extremidades 3' e 5' do genoma são importantes para a iniciação e regulação da síntese do RNA viral. Na região 3', conhecida como leader sequence, encontra-se o sítio de iniciação e na região 5' (trailer sequence) encontra-se o sítio de poliadenilação que corresponde ao término do RNA, ambas regiões são conservadas e importantes para a síntese de um RNA mensageiro senso positivo. Separando cada gene há regiões intergênicas ou há overlaps (pequenas sequências compartilhadas que estão limitados a sinais de transcrição). Ainda não se sabe a função da grande região não codificante presente no genoma do vírus.

Esquema do genoma de Ebola virus. Évelyn Helena A. Mata. Adaptado de WILSON, J. A., BOSIO, M. C, HART, K. M., 2001.
O gene GP codifica duas proteínas: uma glicoproteína secretada (SGP), geralmente liberada das células infectadas na forma de homedímero; e uma glocoproteína estrutural (GP), que permanece ancorada na membrana. O papel de SGP ainda não é claro, mas parece ser importante na patogênese da doença. Já a molécula GP possui a importante função de iniciar a infecção, se ligando em receptores ainda desconhecidos de células horspedeiras[18][19].
Classificação[]
De acordo com o Comitê Internacional de Taxonomia de Vírus (ICTV), o vírus responsável pela epidemia do Ebola em 2014, pertence a ordem Mononegavirales, família Filoviridae e gênero Ebolavirus.
Esta ordem compreende vírus de RNA com fita simples não segmentado, com polaridade negativa (complementar ao RNAm) e capsídeos de simetria helicoidal. O material genético deles, quando isolados, não são infecciosos, pois precisam ser transcritos para a forma positiva por uma RNA polimerase viral[20].
Hospedeiros[]
O hospedeiro natural do vírus Ebola ainda não é definido e isso impediu que até hoje que se implementassem políticas de prevenção que visem controlar e eliminar reservas virais de transmissão para populações humana[12]. Há suspeitas que o morcego-da-fruta possa ser o hospedeiro natural em função se sua capacidade de propagar o vírus sem ser infectado porém ainda não foi possível isolar o vírus a partir do morcego[21]. Contudo, infecções experimentais de morcegos-da-fruta e morcegos insetívoros mostraram que esses animais são capazes de suportar a replicação do ebolavírus sem apresentar doença, mesmo com altos níveis de vírus circulante, o que reforça a teoria de que o morcego é o reservatório do vírus[22].

Morcego-da-fruta africano, considerado um potencial reservatório do ebolavírus. https://commons.wikimedia.org/wiki/File:Epauletted_Fruit_Bat_(Epomophorus_wahlbergi_or_crypturus)_(6042096470).jpg?uselang=pt-br
Humanos e primatas como os chimpanzés , gorilas e macacos são os principais acometidos pelo vírus e o ebolavírus pode ser transmitido diretamente de primatas para humanos[21], como no caso da espécie Reston em macacos cinomolgos na Virgínia em 1989. No caso, os macacos estavam sob importação das Filipinas para os Estados unidos e apresentaram febre hemorrágica e alta mortalidade, sendo isolados em uma instalação de quarentena em Reston na Virgínia. O agente causador da doença foi identificado como uma variação do ebolavírus que foi nomeada com o nome da região (Reston). Em alguns manipuladores desses macacos, ainda que poucos, detectou-se o vírus por métodos sorológicos. Porém, não foram registradas mortes e nem casos de doença severa. A transmissão de outros primatas para humanos também foi observada no caso do etnólogo na costa do marfim em 1994. Acredita-se que o etnólogo tenha contraído o vírus durante a realização de uma necrópsia em um cadáver de chimpanzé. Dessa vez, porém, o vírus foi capaz de causar a doença no etnólogo[23]. A cepa ébolavírus Reston (REBOV) também pode ser transmitida para porcos que chegam a apresentar os sintomas[21] enquanto a cepa EBOV pode infectar cães necrófagos na África e manterem-se assintomáticos [24]. Roedores e Antílopes também podem ser infectados e apresentar risco de transmissão para humanos[25][26].
Multiplicação[]
O processo de multiplicação dos vírus pode ser por meio do ciclo lítico ou do ciclo lisogênico. O Ebola vírus realiza somente o ciclo lítico, isso significa que o material genético viral, que no caso é RNA, depois de liberado na célula hospedeira passa a controlar a maquinaria celular, matando a célula no final do processo. Em momento algum o material genético se funde ao DNA da célula alvo nesse tipo de ciclo (REFERENCE for this paragraph?).
A primeira etapa do ciclo de vida do ebola está na aderência da partícula viral (vírion) a sua célula alvo, isso é feito através do reconhecimento de receptores proteicos expressos na membrana celular das células do hospedeiro (e.g. lectinas do tipo-C, DC-SIGN, L-SIGN, Axl, Dtk, Mer) [27][28]. Uma vez aderida à membrana, a endocitose do vírion se dá a partir da ativação de certos receptores nos quais ele se ligou (como o receptor Axl[29]). O endossomo e lisossomo formados a partir da endocitose então degradam a membrana viral por meio de proteases endossomais (catepsinas B e L) [30], o pH desses compartimentos é de fundamental importância para que ocorra a fusão da partícula viral com o endossomo/lisossomo [31]. Essa fusão acontece devido a exposição e ativação de uma glicoproteína viral de superfície durante a atividade degradativa das vesículas [31], essa glicoproteína por sua vez interage com a proteína Niemann–Pick C1 do endossomo/lisossomo, resultando na fusão entre vírion e vesícula [32][33].
Depois da fusão da membrana, o nucleocapsídeo da partícula viral é descartado, liberando o material genético do ebola, que será transcrito em mRNA com o auxílio de um complexo entre as proteínas VP30, VP35, NP e a polimerase L, que são proteínas associadas ao nucleocapsídeo do vírus [34]. A sinalização para a troca da etapa de transcrição para a de replicação acontece por meio da fosforilação de VP30 [35].
Seguindo a etapa de replicação do material genético, o processo de montagem das partículas virais começa a ser feita, a partir desse momento as moléculas de ácido nucleico são envoltas pelas proteínas do nucleocapsídeo e suas proteínas associadas [34]. Com as partículas virais montadas, a proteína de matriz VP40 interage com a face interna da membrana plasmática da célula infectada, estimulando o brotamento do ebola, pouco é conhecido sobre o processo de como a proteína VP40 interage com a membrana e forma o envelope viral filamentoso típico do ebola[36].
Patogenia[]
O vírus entra no corpo humano via mucosa, lesão da barreira epitelial ou ainda via parênquima, infectando diversos tipos celulares, sendo os macrófagos e as células dendríticas os tipos celulares mais susceptíveis nos estágios iniciais do processo infeccioso[38]. A fixação do vírus na célula é mediada pelas glicoproteínas do envelope (GP) que interagem com moléculas presentes na superfície das membranas celulares como, por exemplo, lectinas, catepsinas, receptores de tirosina quinases e integrinas[39].
A ligação da partícula viral na superfície celular estimula o processo conhecido como macropinocitose, onde a célula engloba partículas presentes no meio extracelular por meio de invaginações de membrana, permitindo a entrada do vírus - que fica englobado numa vesícula - na célula. Este processo se diferencia da pinocitose por não ser mediana por clatrinas, devido ao tamanho da partícula viral[40].
Uma vez dentro da célula, as alterações de pH que ocorrem no interior das vesículas lisossomais permitem a retirada do envelope viral e, assim, o vírus pode interagir com uma proteína presente na membrana dos lisossomos denominada NPC1 (proteína Niemann-Pick tipo C1), o que permite sua evasão vesicular. Numa célula normal, essa proteína medeia o tráfego intracelular de colesterol. Estudos realizados mostram que uma mutações no gene que a codifica comprometem a capacidade do vírus de conseguir infectar a célula[41][42].
No citoplasma celular, o vírus começa a transcrever seus genes e dá início a seu processo de replicação, que leva a necrose das células infectadas.
A infecção de macrófagos e células dendríticas permite a disseminação sistêmica do vírus por meio da supressão da resposta imune inata via interferons do tipo I nessas células. Além disso, as células dendríticas afetadas deixam de desempenhar sua função como mediadora da resposta imune adaptativa. A apresentação de antígenos para os linfócitos T fica comprometida, prejudicando o desenvolvimento de respostas imunológicas específicas para o antígeno[39][43].
Já os macrófagos infectados começam a produzir uma série de mediadores que levam ao aparecimento de febre hemorrágica. Entre eles, fatores teciduais que começam a ser expressos na membrana dos macrófagos e ativam a coagulação intravascular sistêmica além de citocinas e quimiocinas que induzem a disfunção vascular, hipotensão, e falência de múltiplos órgãos[39][43].
Evasão do Sistema Imune[]
O vírus Ebola utiliza dois mecanismos principais para interferir no sistema imune do paciente infectado. O primeiro é o bloqueio da produção de interferons do tipo I pelas proteínas VP24 e VP35. Além disso, o vírus também pode usar as glicoproteínas do envelope (GP) para se evadir da resposta imune[44].

Modelo de interação da inibição da via RIG-1 pela proteína viral VP35 e sua ligação na molécula de dsDNA. doi: 10.1089/vim.2014.0066
A proteína viral VP35 bloqueia a detecção do RNA de fita dupla (dsRNA) formado durante a fase de replicação viral. Ela possui um domínio inibidor de interferon (IFN inhibitory domain: IID ) na sua porção C-terminal. Esse domínio possui três regiões ativas: o sítio de ligação para proteína NP, o sítio de ligação para a porção fosfatada do dsRNA e o sítio que se ligará na porção terminal do dsRNA. As duas últimas impedem a ativação das vias RIG-1 (retinoic acid-inducible gene 1) e PKR (protein kinase R), que são receptores de reconhecimento de padrões intracelulares de moléculas de dsRNA e estão ligados a resposta imune antiviral[44][45].
Estudos comparando a estrutura e atividade da proteína VP35 de Zaire ebolavirus e Reston ebolavirus' mostraram diferenças funcionais e morfológicas entre as proteínas nas duas espécies, o que poderia estar relacionado com o fato da espécie 'Reston ebolavirus 'não ser capaz de infectar humanos[46][47].
Já proteína viral VP24 compromete a síntese de interferons do tipo I por intervir na via de sinalização JAK/STAT, que é requerida para que a célula consiga responder as citocinas. De acordo com os estudos realizados, a proteína VP24 se liga a proteína carioferina-alfa1, presente no envelope nuclear, prevenindo o transporte de STAT1 para o núcleo da célula e, assim, comprometendo o padrão da expressão gênica.[48]
As glicoproteínas do envelope por sua vez, parecem ter atividade anti-tetherin. A theterin (sem tradução para o português) é uma proteína de superfície responsiva a interferons e tem por função evitar o brotamento viral durante o processo de liberação de novas partículas do vírus. Desse modo, o vírus consegue se espalhar pelo organismo[49].
Diagnóstico laboratorial[]
Diagnóstico
O diagnóstico laboratorial é feito pela detecção de antígenos virais ou RNA viral em amostras de sangue ou fluidos corporais e pode ser feito por ensaios imunológicos isolamento viral ou RT-PCR. Pacientes apresentam leucopenia com linfopenia inicialmente, e depois neutrofilia, plaquetas baixas, aumento de transaminases, hiperproteinemia, aumento do tempo de coagulação. O diagnóstico diferencial do vírus ebola é feito com base nos sintomas do paciente, que costumam aparecerem 2-21 dias após a infecção começar. Devido à necessidade de rápido diagnóstico, foi desenvolvido um kit prático contendo ferramentas para a realizaçao de um teste de diagnóstico por RT-PCR que pode ser utilizado após 3 dias do aparecimento dos sintomas. Esse kit contém primers , enzimas , nucleotídeos , agente fluorescente e permite avaliar em 4 horas a presença ou não do vírus pela multiplicação exponencial do material genético viral. Esse método é utilizado em lugares onde a doença está sendo considerada grave/endêmica.[50]
Durante a avaliação de possíveis paciente contaminados com Ebola é importante considerar diagnósticos alternativos ou concorrentes incluindo distúrbios infecciosos e não infecciosos. O diagnóstico diferencial depende , em parte , dos sintomas apresentados , locais por onde o indivíduos passou e reside , contato do paciente com indivíduos doentes , histórico de vacinação e idade. Dependendo se o paciente vive ou esteve no oeste africano ou África central deve-se levar em consideração outras doenças que apresentam sintomas semelhantes como ; Malaria , febre de Lassa , febre tifóide , gripe , sarampo e doença de Marburg. [51]
Epidemiologia[]
Desde 2013 o mundo tem visto um surto preocupante da doença viral Ebola, mas, diferentemente de outras doenças virais, essa não tem sua disseminação tão fácil, pois sua transmissão é feita de pessoa a pessoa, não ocorrendo por via aérea[52]. Os primeiros casos relatados da doença por vírus Ebola datam de 1976 na atual República Democrática do Congo (318 casos)[53], desde então dezenas de surtos de ebola tem ocorrido na África [54] . As evidências mais antigas do início do surto recente de Ebola na África Ocidental datam de março de 2014, dia 10 serviços de saúde dos distritos de Guéckédou e Macenta na Guiné relataram grupos de pacientes com uma doença não identificada com alta taxa de mortalidade, no dia 18 equipes dos Médicos Sem Fronteiras chegaram ao distrito de Guéckédou, posteriormente testes sanguíneos nos pacientes afetados testaram positivo para o vírus Ebola em grande parte dos casos[55].
A transmissão do vírus ebola acontece por meio de três principais modos[52]:
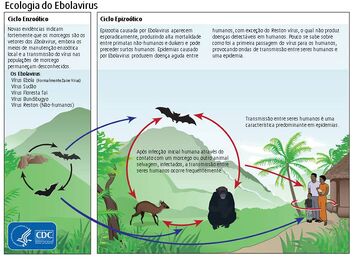
Ciclo de transmissão do vírus Ebola. Fonte CDC
- Contato direto com fluídos corporais (sangue, fezes, saliva, suor, leite materno, sêmen, entre outros) de pessoas infectadas em mucosas ou lesões cutâneas, incluindo o contato com fluídos de cadáveres infectados;
- Objetos contaminados com o vírus, como em seringas e agulhas;
- Ou então por meio do contato com animais (como macacos ou morcegos) portadores do vírus.
O período de incubação, ou seja, o intervalo de tempo entre a exposição ao vírus e o aparecimento dos primeiros sintomas é em média de 12 dias, podendo passar de 21 dias em casos mais raros[56]. O contágio por pessoas infectadas só acontece a partir do momento em que surgem os primeiros sintomas, estágio no qual a concentração viral em fluídos corporais é alta, antes desse período não ocorre a transmissão[56].

Mapa de distribuição do número total de casos do vírus Ebola no nos países mais afetados no surto recente do oeste africano. Fonte: CDC
O estudo epidemiológico do surto recente de ebola indica que o primeiro paciente infectado, um garoto de 2 anos da vila de Guéckédou, no sudeste da Guiné, contraiu o vírus ao brincar em uma árvore oca a qual era habitada por morcegos insetívoros da espécie Mops condylurus, que são um dos reservatórios naturais do vírus [57]. Essa transmissão humano-animal é na maioria dos casos a principal causa para o início de um surto ou epidemia de ebola[52]. Doente, o garoto veio a falecer no dia 6 de dezembro de 2013, uma semana depois, sua mãe, irmã e avó também morreram pelo ebola, no funeral outras pessoas foram contagiadas, assim como profissionais da saúde que trataram algum desses casos, dessa forma o vírus foi se espalhando cada vez mais para outras cidades[58]. Guéckédou está localizada muito próxima da fronteira com Serra Leoa e Libéria, o que facilitou a dispersão do vírus para esses dois países.
De acordo com a Organização Mundial da Saúde, somente no dia 25 de março de 2014 o ministro de saúde da Guiné reportou um surto de ebola no sudeste do país. No dia 24 já existiam 86 casos suspeitos de ebola, com 56 mortes ao total[59]. Resultados preliminares do Instituto Pasteur em Lyon (França) indicaram o Zaire ebolavirus como o agente causador[59]. No dia 1º de maio o ministro de saúde da Guiné reportou 226 casos clínicos cumulativos de ebola, com 149 mortes; desses casos, 127 foram confirmados laboratorialmente com ebola, incluindo 81 mortes[60]. No dia 2 de maio o Ministro de Saúde e Bem-Estar Social da Libéria reportou 13 casos (6 confirmados, 2 prováveis e 5 casos suspeitos) e 11 mortes[60]. Já no dia 27 de maio foram reportados em Kailahun (Serra Leoa) 16 casos (7 confirmados laboratorialmente e 9 suspeitos) e 5 mortes, esse distrito faz fronteira com Guéckédou na Guiné, além da fronteira com a Libéria[61]. Todos esses casos reportados mostraram que a partir do dia 27 de maio de 2014 o ebola já havia se espalhado oficialmente por 3 países: Guiné, Libéria e Serra Leoa.
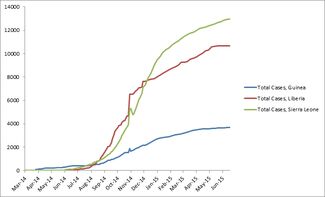
Número total de casos suspeitos, prováveis e confirmados do vírus Ebola na Guiné, Libéria e Serra Leoa de 25/03/14 a 24/06/15. Fonte: CDC
No dia 17 de junho de 2015 Guiné, Libéria e Serra Leoa somaram os três 27 305 casos e 11 169 mortes, com 76 casos nos últimos 21 dias; todos os números são cumulativos de mortes ou casos confirmados, prováveis e suspeitos[62]. Outros países que já reportaram ebola (Nigéria, Senegal, Estados Unidos, Espanha, Mali, Reino Unido e Itália) somam 36 casos e 15 mortes, com nenhum novo caso no ano de 2015[62]. O surto de ebola na Libéria foi declarado encerrado no dia 9 de maio, com nenhum novo caso há pelo menos 42 dias a partir desse dia[62].
A transmissão humano-humano (interpessoal) é o fator predominante para o surgimento novos casos em um caso epidemiológico já estabelecido de ebola, os sintomas causados por essa doença favorecem ainda mais esse tipo de transmissão (diarreia, vômitos e, em casos específicos, hemorragia[63]). O grupo de risco para o contágio do vírus ebola são aquelas pessoas que têm um contato direto com indivíduos infectados ou seus fluídos corporais, além dos cadáveres infectados; dessa forma, profissionais da saúde ou outros trabalhadores intimamente inseridos em áreas de risco devem, obrigatoriamente, vestir equipamentos de proteção individuais [64](máscara, luvas, protetores dos olhos e deixar a menor quantidade possível de superfície corporal exposta). Familiares próximos cuidadores de pessoas infectadas em estágio tardio que não têm contato direto com o infectado ou os seus fluídos corporais apresentam uma chance de contágio muito baixa, já aqueles que tiveram contato apresentam um risco elevado[64]. Aquelas pessoas que vivem em área afetada pelo ebola e que seguem as regras de profilaxia manifestam pouca chance de contágio.
Prevenção e controle[]
Profilaxia
Como o vírus Ebola não se propaga pelo ar, a prevenção é evitar o contato com sangue e fluidos de doentes (urina, fezes, saliva, suor, vômito, leite materno, sêmen e fluidos vaginais), estando atento à higiene pessoal, por exemplo lavar as mãos frequentemente e utilizar álcool em gel. Recomenda-se não visitar ou entrar em áreas que tenham sido afetadas pelo surto de Ebola, além de evitar a entrada nos centros de tratamento no Oeste da África. [65]
- Evitar o uso de materiais usados pelos doentes ou neles, como roupas, agulhas, máscaras, luvas ou outros equipamentos médicos e também evitar o contato com animais infectados. [65]
- Evitar funerais e outros rituais fúnebres que entrem em contato com o corpo de alguém que morreu por Ebola. [65]
- Não praticar qualquer tipo de relação sexual (oral, anal ou vaginal) com um paciente que se tratou de Ebola ou suspeito da doença, a fim de evitar o contato com os fluidos vaginais ou o sêmen masculino infectado. [65]
- Caso tenha viajado a alguma área afetado pelo surto de Ebola, evitar contato com morcegos e primatas ou sangue e fluidos desses animais e a ingestão de alimentos crus derivados dos mesmos. [65]
- Ao aproximar-se de pacientes infectado por Ebola, utilizar equipamentos de proteção adequados que cobrem todo o corpo, da cabeça aos pés. O equipamento deve ser retirado com cuidado para evitar contaminação.
Vacinas
Uma vacina contra o Ebola é muito importante, tanto para controlar a epidemia atual quanto para evitar que ocorra novamente. Devido à capacidade de evasão do sistema imune, tem sido relativamente difícil criar esta vacina. Entretanto, atualmente há diversos testes clínicos em andamento que tentam solucionar este problema. Por hora, não há nenhuma vacina aprovada pela OMS.[66]
A maior parte das vacinas que tem sido desenvolvidas são baseadas no vírus encontrado no Zaire em 1976, e não do vírus que está circulando atualmente. Há o registro de um grupo de pesquisadores chineses[67] que está testando uma vacina baseada nas glicoproteínas do tipo atual.
Pesquisadores do Public Health Agency of Canada's National Microbiology Laboratory (NML) desenvolveram uma vacina experimental, que atualmente está em fase III. Os estudos em animais mostraram-se promissores tanto em não infectados quanto naqueles imunizados logo após serem expostos ao vírus. A vacina é baseada em um vírus de estomatite vesicular combinado com um gene não infeccioso do vírus ebola, o que permite que haja resposta imune contra o vírus.[68]
Os modelos animais primários utilizados para o desenvolvimento da vacina são os porcos da Guinea e primatas não humanos pois a patogenicidade e progressão da doença se assemelham mais com o de humanos. Posteriormente através de passagens em série em ratos foi possível desenvolver o modelo murino que , apesar de ser menos preditiva , permite o estudo de influencias genéticas no desenvolvimento da doença. Dentre estes modelos , os primatas não humanos são os que mais se assemelham à progressão e sintomas em humanos.[2]
Virus vivos atenuados e proteínas recombinantes tem sido utilizadas com sucesso em determinada variedade de vacinas porém a segurança e imunogenicidade de vacinas baseada em genes mostra-se cada vez mais atraente. Mas enquanto vacinas de DNA mostram-se eficientes para roedores , em humanos os resultados não foram muito expressivos. Há também uma abordagem sendo desenvolvida baseada na replicação defeituosa de adenovírus para a vacina contra Ebola e os resultados mostram eficácia da imunidade superior para a resposta celular e humoral.Os animais (roedores) submetidos a essa abordagem mostraram proteção imune completa contra o vírus.[2]
Bibliografia[]
- ↑ 1. Organização Mundial da Saúde Febre hemorrágica de Marburgo – resumo de informações. Disponível em: <http://www.who.int/csr/disease/marburg/en/Marburg-abril.pdf>
- ↑ 2,0 2,1 2,2 2,3 Peters, C. J.; LeDuc, J. W. An
Introduction to Ebola: The Virus and the Disease. The Journal of Infectious Diseases 1999;179(Suppl 1):ix–xvi
Erro de citação: Etiqueta inválida
<ref>; Nome ":5" definido várias vezes com conteúdo diferente - ↑ 3,0 3,1 Chippaus, J. P. Outbreaks of Ebola virus disease in Africa: the beginnings of a tragic saga. Journal of Venomous Animals and Toxins including Tropical Diseases 2014, 20:44
- ↑ Bres, P. The epidemic of Ebola haemorrhagic fever in Sudan and Zaire, 1976: introductory note. Bulletin of the World Health Organization 1978, 56 (2), 245
- ↑ Members of the Study Team. Ebola haemorrhagic fever in Sudan, 1976. Bulletin of the World Health Organization 1978, 56 (2), 247-270
- ↑ . Members of the International Commission. Ebola haemorrhagic fever in Zaire, 1976. Bulletin of the World Health Organization 1978, 56 (2), 271-293
- ↑ J.J. Muyembe-Tamfum et al. Ebola virus outbreaks in Africa: Past and presente. The Onderstepoort Journal of Veterinary Research. 2011, v79i2, 451
- ↑ 8,0 8,1 8,2 CDC: Outbreaks Chronology: Ebola Virus Disease. Disponível em: <http://www.cdc.gov/vhf/ebola/outbreaks/history/chronology.html#modalIdString_outbreaks>
- ↑ 9,0 9,1 WHO - Origins of 2014 Ebola epidemic. Disponível em <http://www.who.int/csr/disease/ebola/one-year-report/virus-origin/en/>
- ↑ Sylvain Baiz et al. Emergence of Zaire Ebola Virus Disease in Guinea. The new england journal of medicine, 2015, 371;15
- ↑ http://evunix.uevora.pt/~sinogas/TRABALHOS/2003/Ebola.htm
- ↑ 12,0 12,1 Sullivan N, Yang Z-Y, Nabel GJ. Ebola Virus Pathogenesis: Implications for Vaccines and Therapies. Journal of Virology. 2003;77(18):9733-9737. doi:10.1128/JVI.77.18.9733-9737.2003.
- ↑ Roth JA, Richt JA, Morozov IA. Vaccines and Diagnostics for Transboundary Animal Disease. Dev Biol (Basel), Basel, Karger, 2013, vol 135, pp 201-209.
- ↑ 1. Santos NOS, Romanos MTV, Wigg MD. Introdução à virologia Humana. Ed. Guanabara Koogan, 2ª ed, Rio de Janeiro, 2008, pg 488 -492.
- ↑ 1. Milanga M et al. Ebola Hemorrhagic Fever(EHF): Mechanism of Transmission and Pathogenicity. J Nippon Med Sch 2001; 68(5)
- ↑ Lee JE, Saphire EO. Ebolavirus glycoprotein structure and mechanism of entry. Future virology. 2009;4(6):621-635. doi:10.2217/fvl.09.56.
- ↑ http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3787895/
- ↑ SANCHEZ, A. Ebola Viruses. Encyclopedia of Life Sciences, 2001
- ↑ WILSON, J. A. et al. Ebola virus: the search for vaccines and treatments. Cellular and Molecular Life Sciences, 58, 1826-1841, 2001
- ↑ Jens H. Kuhn "Proposal for a revised taxonomy of the family Filoviridae: classification, names of taxa and viruses, and virus abbreviations". Arch Virol. 2010 Dec; 155(12): 2083–2103. doi:10.1007/s00705-010-0814-x
- ↑ 21,0 21,1 21,2 Weingartl HM, Nfon C, Kobinger G. (2013). "Review of Ebola virus infections in domestic animals". Dev Biol (Basel) 135 DOI:10.1159/000178495. PMID 23689899.
- ↑ Fields' virology / editors-in-chief, David M. Knipe, Peter M. Howley ; associate editors, Diane E. Griffin et al. - 5th ed.cap. 40 pag 1433
- ↑ Fields' virology / editors-in-chief, David M. Knipe, Peter M. Howley ; associate editors, Diane E. Griffin et al. - 5th ed.cap. 40 pag 1412-1413
- ↑ Allela L, Boury O, Pouillot R, Délicat A, Yaba P, Kumulungui B, Rouquet P, Gonzalez JP, Leroy EM. (2005). "Ebola virus antibody prevalence in dogs and human risk". Emerging Infect. Dis. 11 (3): 385–90.DOI:10.3201/eid1103.040981. PMID 15757552.
- ↑ World Health Organization Ebola virus disease Fact sheet N°103 Updated April 2015 (http://www.who.int/mediacentre/factsheets/fs103/en/)
- ↑ Gerald Amandu Matua et al. Ebola hemorrhagic fever outbreaks: strategies for effective epidemic management, containment and control. The Brazilian Journal of Infectious Diseases Volume 19, Issue 3, May–June 2015, Pages 308–313
- ↑ Alvarez, Carmen P., et al. "C-type lectins DC-SIGN and L-SIGN mediate cellular entry by Ebola virus in cis and in trans." Journal of virology 76.13 (2002): 6841-6844.
- ↑ Shimojima, Masayuki, et al. "Tyro3 family-mediated cell entry of Ebola and Marburg viruses." Journal of virology 80.20 (2006): 10109-10116.
- ↑ Shimojima, Masayuki, Yasuhiro Ikeda, and Yoshihiro Kawaoka. "The mechanism of Axl-mediated Ebola virus infection." Journal of Infectious Diseases 196.Supplement 2 (2007): S259-S263.
- ↑ Misasi, John, and Nancy J. Sullivan. "Camouflage and misdirection: the full-on assault of Ebola virus disease." Cell 159.3 (2014): 477-486.
- ↑ 31,0 31,1 Takada, Ayato, et al. "A system for functional analysis of Ebola virus glycoprotein." Proceedings of the National Academy of Sciences 94.26 (1997): 14764-14769.
- ↑ Carette, Jan E., et al. "Ebola virus entry requires the cholesterol transporter Niemann-Pick C1." Nature 477.7364 (2011): 340-343.
- ↑ Côté, Marceline, et al. "Small molecule inhibitors reveal Niemann-Pick C1 is essential for Ebola virus infection." Nature 477.7364 (2011): 344-348.
- ↑ 34,0 34,1 Mühlberger, Elke, et al. "Comparison of the transcription and replication strategies of Marburg virus and Ebola virus by using artificial replication systems." Journal of virology 73.3 (1999): 2333-2342.
- ↑ Martinez, Miguel J., et al. "Role of VP30 phosphorylation in the Ebola virus replication cycle." Journal of Infectious Diseases 204.suppl 3 (2011): S934-S940.
- ↑ Stahelin, Robert V. "Membrane binding and bending in Ebola VP40 assembly and egress." Frontiers in microbiology 5 (2014).
- ↑ http://midia.atp.usp.br/impressos/lic/modulo03/diversidade_biologica_filogenia_PLC0019/Bio_Filogenia_top09.pdf
- ↑ L Falasca et al; Molecular mechanisms of Ebola virus pathogenesis:focus on cell death; Cell Death Differ. 2015 May 29. doi: 10.1038/cdd.2015.67.
- ↑ 39,0 39,1 39,2 Mahanty S, Bray M.; Pathogenesis of filoviral haemorrhagic fevers. Lancet Infect Dis. 2004 Aug;4(8):487-98.
- ↑ http://jonlieffmd.com/blog/the-very-intelligent-ebola-virus-takes-front-and-center
- ↑ Carette JE; Ebola virus entry requires the cholesterol transporter Niemann-Pick C1. Nature. 2011 Aug 24;477(7364):340-3. doi: 10.1038/nature10348
- ↑ Herbert AS et al; Niemann-pick c1 is essential for ebolavirus replication and pathogenesis in vivo. MBio. 2015 May 26;6(3). pii: e00565-15. doi: 10.1128/mBio.00565-15
- ↑ 43,0 43,1 Bray M., Geisbert TW. Ebola virus: the role of macrophages and dendritic cells in the pathogenesis of Ebola hemorrhagic fever.Int J Biochem Cell Biol. 2005 Aug;37(8):1560-6. Epub 2005 Mar 7.
- ↑ 44,0 44,1 Audet J., Kobinger GP.; Immune evasion in ebolavirus infections. Viral Immunol. 2015 Feb;28(1):10-8. doi: 10.1089/vim.2014.0066.
- ↑ Mohamadzadeh M., Chen L, Schmaljohn AL. How Ebola and Marburg viruses battle the immune system. Nat Rev Immunol. 2007 Jul;7(7):556-67.
- ↑ Leung DW, Shabman RS, Farahbakhsh M, et al. Structural and functional characterization of Reston Ebola virus VP35 interferon inhibitory domain. J Mol Biol 2010;399:347–357.
- ↑ Kash JC, Mu¨hlberger E, Carter V, et al. Global suppression of the host antiviral response by Ebola- and Marburg viruses: increased antagonism of the type I interferon response is associated with enhanced virulence. J Virol 2006; 80:3009–3020.
- ↑ Shabman RS, Gulcicek EE, Stone KL, and Basler CF. The Ebola virus VP24 protein prevents hnRNP C1/C2 binding to karyopherin a1 and partially alters its nuclear import. J Infect Dis 2011;204 Suppl:S904–S910.
- ↑ Kaletsky RL, Francica JR, Agrawal-Gamse C, and Bates P. Tetherin-mediated restriction of filovirus budding is antagonized by the Ebola glycoprotein. Proc Natl Acad Sci U S A 2009;106:2886–2891.
- ↑ http://www.thermofisher.com/en/about-us/training-program-collaboration-to-prevent-spread-of-ebola.html
- ↑ What obstetrician-gynecologists should know about Ebola: a perspective from the Centers for Disease Control and Prevention. Jamieson DJ, Uyeki TM, Callaghan WM, Meaney-Delman D, Rasmussen SA Obstet Gynecol. 2014;124(5):1005.
- ↑ 52,0 52,1 52,2 "Transmission." Centers for Disease Control and Prevention. Centers for Disease Control and Prevention, 12 Feb. 2015. Web. 22 Mar. 2015. <http://www.cdc.gov/vhf/ebola/transmission/index.html>.
- ↑ Burke, J., et al. " Ebola Hemorrhagic-fever in Zaire, 1976-Report of an International-Comission." Bulletin of the World Health Organization 56.2 (1978): 271-293.
- ↑ "Outbreaks Chronology: Ebola Virus Disease." Centers for Disease Control and Prevention. Centers for Disease Control and Prevention, 6 Mar. 2015. Web. 22 Mar. 2015. <http://www.cdc.gov/vhf/ebola/outbreaks/history/chronology.html>.
- ↑ Baize, Sylvain, et al. "Emergence of Zaire Ebola virus disease in Guinea." New England Journal of Medicine 371.15 (2014): 1418-1425.
- ↑ 56,0 56,1 Team, WHO Ebola Response. "Ebola virus disease in West Africa—the first 9 months of the epidemic and forward projections." N Engl J Med 371.16 (2014): 1481-95.
- ↑ Saéz, Marí A, et al. "Investigating the Zoonotic Origin of the West African Ebola Epidemic." EMBO Molecular Medicine 7.1 (2014): 17-23.
- ↑ Grady, Denise, and Sheri Fink. "Tracing Ebola’s Breakout to an African 2-Year-Old." The New York Times. The New York Times, 09 Aug. 2014. Web. 20 June 2015.
- ↑ 59,0 59,1 "Previous Updates: 2014 West Africa Outbreak." Centers for Disease Control and Prevention. Centers for Disease Control and Prevention, 10 June 2015. Web. 20 June 2015.
- ↑ 60,0 60,1 "Ebola Virus Disease, West Africa (Situation as of 2 May 2014)." - WHO. N.p., n.d. Web. 20 June 2015.
- ↑ Ebola Virus Disease, West Africa (Situation as of 27 May 2014)." - WHO. N.p., n.d. Web. 20 June 2015.
- ↑ 62,0 62,1 62,2 "Ebola Situation Report - 17 June 2015". 17 June 2015. Retrieved 20 Jun 2015.
- ↑ Team, WHO Ebola Response. "Ebola virus disease in West Africa—the first 9 months of the epidemic and forward projections." N Engl J Med 371.16 (2014): 1481-95.
- ↑ 64,0 64,1 Dowell, Scott F., et al. "Transmission of Ebola hemorrhagic fever: a study of risk factors in family members, Kikwit, Democratic Republic of the Congo, 1995." Journal of Infectious Diseases 179.Supplement 1 (1999): S87-S91.
- ↑ 65,0 65,1 65,2 65,3 65,4 http://www.cdc.gov/vhf/ebola/prevention/index.html
- ↑ http://www.who.int/medicines/emp_ebola_q_as/en/
- ↑ http://www.thelancet.com/journals/lancet/article/PIIS0140-6736(15)60553-0/fulltext
- ↑ http://jid.oxfordjournals.org/content/204/suppl_3/S1066.full